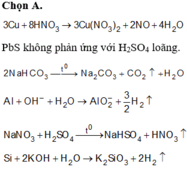giúp e với ạ,e cần gấp,e cảm ơn
Hãy sử dụng những chất có sẵn: Cu, Fe, KOH, C6H12O6 (glucozơ), dung dịch H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit
b) H2SO4 đặc có những tính chất hóa học riêng
Viết phương trình hóa học cho mỗi thí nghiệm.