c% của 250g dd ba(oh)2 có chứa 0,15mol ba(oh)2

Những câu hỏi liên quan
dẫn 30,8g Co2 vào 250g dd ba(oh)2 20,52% . Tính C% dd thu được
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{30,8}{44}=0,7\left(mol\right)\\n_{Ba\left(OH\right)_2}=\dfrac{250\cdot20,52\%}{171}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối axit
PTHH: \(2CO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HCO_3\right)_2\)
Tính theo Ba(OH)2
Theo PTHH: \(\left\{{}\begin{matrix}n_{Ba\left(HCO_3\right)_2}=0,3\left(mol\right)\\n_{CO_2\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Ba\left(HCO_3\right)_2}=0,3\cdot259=77,7\left(g\right)\\m_{CO_2\left(dư\right)}=0,1\cdot44=4,4\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{CO_2}+m_{ddBa\left(OH\right)_2}-m_{CO_2\left(dư\right)}=276,4\left(g\right)\)
\(\Rightarrow C\%_{Ba\left(HCO_3\right)_2}=\dfrac{77,7}{276,4}\cdot100\%\approx28,11\%\)
Đúng 1
Bình luận (0)
Để trung hòa một lượng dd có chứa 189g HNO3 đầu tiên dùng dd có chứa 112g KOH. Sau đó lại dùng thêm dd BA(OH)2 25% để trung hòa hết axit
a.Viết PTHH
b. Tính khối lượng dd BA(OH)2 đã dùng
a) nHNO3=189/63=3(mol); nKOH= 112/56=2(mol)
PTHH: KOH + HNO3 -> KNO3 + H2O
Ta có: 3/1 > 2/1
-> KOH hết, HNO3 (dư)
nHNO3(p.ứ)= nKOH=2(mol) -> nHNO3(dư)=3-2=1(mol)
2 HNO3 + Ba(OH)2 -> Ba(NO3)2 + 2 H2O
1________0,5(mol)
b) => mBa(OH)2= 171.0,5= 85,5(g)
Đúng 1
Bình luận (3)
Để trung hòa dd chứa 109,5g HCl, lần đầu tiên cho dd chứa 112g KOH. Sau đó cho thêm dd Ba(OH)2 25% để trung hòa hết axit. Vậy khối lượng dd Ba(OH)2 đã dùng là bao nhiêu?
PTHH: \(HCl+KOH\rightarrow KCl+H_2O\)
\(2HCl_{\left(dư\right)}+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
Axit dư nên tính theo KOH
Ta có: \(\left\{{}\begin{matrix}\Sigma n_{HCl}=\dfrac{109,5}{36,5}=3\left(mol\right)\\n_{KOH}=\dfrac{112}{56}=2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow n_{HCl\left(dư\right)}=1\left(mol\right)\)
\(\Rightarrow n_{Ba\left(OH\right)_2}=0,5\left(mol\right)\) \(\Rightarrow m_{ddBa\left(OH\right)_2}=\dfrac{0,5\cdot171}{25\%}=342\left(g\right)\)
Đúng 1
Bình luận (0)
Bài1: Để trung hoà hết 600ml dd HNO3 1M cần V ml dd NaOH1M và Ba(OH)2 0,75M . Giá trị của V là Bài 2: DD A chứa H2SO4 0,01M và HCl 0,03M ; dd B chứa NaOH 0,05M và Ba(OH)2 0,015M . Thể tích ddA cần để trung hoà hết 200ml ddB là
dd chứa hh naoh và ba(oh)2. Để trung hòa 75ml dd A càn dùng 90ml dd HCl 0,1M.khi cho 75ml dd A tác dụng với 1 lượng dư Na2CO3 thấy tạo thành 0,2955g kết tủa. tính nồng độ mol của NaOH và Ba(OH)2
Gọi:
CM NaOH= x (M)
CM Ba(OH)2 = y (M)
nHCl = 0.09*0.1=0.009 mol
OH- + H+ --> H2O
0.009_0.009
Ta có :
0.075x + 0.075y*2 = 0.009
<=> x + 2y = 0.12 (1)
nBaCO3 = 0.2955/197=0.0015 mol
Ba2+ + CO32- ---> BaCO3
=> nBa2+ = 0.0015 mol
<=> 0.075y = 0.0015
<=> y = 0.02
Thay y vào (1) :
x = 0.08
Vậy:
CM NaOH = 0.08 M
CM Ba(OH)2 = 0.02 M
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Ch hh muối CaCO3 và NaHCO3 tác dụng hết với dd HCl. Khí sinh ra được dẫn vào dd Ba(OH)2 dư thu đc 19,7g kết tủa. Số mol hh muối là:
A. 0,1mol
B. 0,05mol
C. 0,15mol
D. 0,075mol
PTHH: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)(1) \(NaHCO_3+HCl\rightarrow NaCl+H_2O+CO_2\uparrow\) (2) \(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3\downarrow+H_2O\) (3). Số mol kết tủa tạo thành: \(n_{BaCO_3}=\dfrac{19,7}{197}=0,1\left(mol\right)\) Theo PTHH (3): \(n_{CO_2}=n_{BaCO_3}=0,1\left(mol\right)\) Theo như PTHH (1),(2) ta thấy rằng: \(n_{CaCO_3}+n_{NaHCO_3}=n_{CO_2\left(1\right)}+n_{CO_2\left(2\right)}=n_{CO_2}=0,1\left(mol\right)\)Vậy số mol hh muối là 0,1 mol => chọn đáp án A đúng.
Đúng 0
Bình luận (0)
Trong các phản ứng sau : (1) dd Na2CO3 + dd H2SO4 (2) dd NH4HCO3 + dd Ba(OH)2 (3) dd Na2CO3 + dd CaCl2 (4) dd NaHCO3 + dd Ba(OH)2 (5) dd (NH4)2SO4 + dd Ba(OH)2 (6) dd NaHSO4 + dd BaCO3 Các phản ứng có đồng thời cả kết tủa và khí là A. (1), (3), (6). B. (2), (5), (6) C. (2), (3), (5). D. (2), (5).
Đọc tiếp
Trong các phản ứng sau :
(1) dd Na2CO3 + dd H2SO4
(2) dd NH4HCO3 + dd Ba(OH)2
(3) dd Na2CO3 + dd CaCl2
(4) dd NaHCO3 + dd Ba(OH)2
(5) dd (NH4)2SO4 + dd Ba(OH)2
(6) dd NaHSO4 + dd BaCO3
Các phản ứng có đồng thời cả kết tủa và khí là
A. (1), (3), (6).
B. (2), (5), (6)
C. (2), (3), (5).
D. (2), (5).
Trong các phản ứng sau :(1) dd Na2CO3 + dd H2SO4 (2) dd NH4HCO3 + dd Ba(OH)2(3) dd Na2CO3 + dd CaCl2 (4) dd NaHCO3 + dd Ba(OH)2(5) dd (NH4)2SO4 + dd Ba(OH)2 (6) dd NaHSO4 + dd BaCO3Các phản ứng có đồng thời cả kết tủa và khí là A. (1), (3), (6) B. (2), (5), 6. C. (2), (3), (5). D. (2), (5).
Đọc tiếp
Trong các phản ứng sau :
(1) dd Na2CO3 + dd H2SO4
(2) dd NH4HCO3 + dd Ba(OH)2
(3) dd Na2CO3 + dd CaCl2
(4) dd NaHCO3 + dd Ba(OH)2
(5) dd (NH4)2SO4 + dd Ba(OH)2
(6) dd NaHSO4 + dd BaCO3
Các phản ứng có đồng thời cả kết tủa và khí là
A. (1), (3), (6)
B. (2), (5), 6.
C. (2), (3), (5).
D. (2), (5).
Đáp án B
Trong các phản ứng đề cho, có 3 phản ứng có đồng thời kết tủa và khí là :
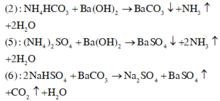
Đúng 0
Bình luận (0)
Cho 200g dd HCl 14,6% tác dụng với 200g dd Ba(OH)2 17,1%. Tính nồng độ% của các chất có trong dd thu được. HCl+Ba(OH)2-> BaCl2 +H2O
nHCl=(200.14,6%)/100=0,8(mol)
nBa(OH)2=(17,1%.200)/100=0,2(mol)
PTHH: Ba(OH)2 +2 HCl -> BaCl2 + 2 H2O
Ta có: 0,8/2 > 0,2/1
=> HCl dư, Ba(OH)2 hết=> Tính theo nHCl
=> nBaCl2=nBa(OH)2=0,2(mol) => mBaCl2= 208.0,2= 41,6(g)
nHCl(dư)=0,8 - 0,2.2=0,4(mol) => mHCl(dư)=0,4.36,5=14,6(g)
mddsau= 200+200=400(g)
C%ddBaCl2=(41,6/400).100=10,4%
C%ddHCl(dư)= (14,6/400).100=3,65%
Chúc em học tốt!
Đúng 3
Bình luận (1)



















