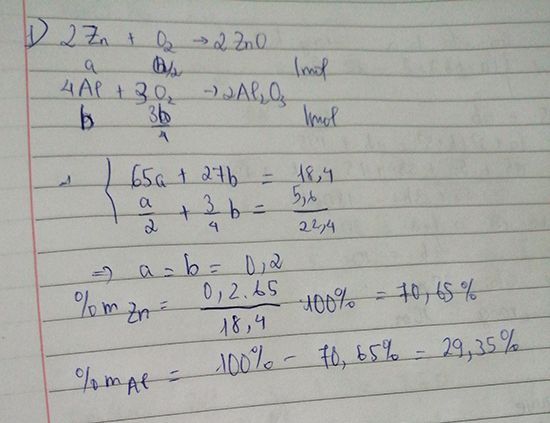Cho 8,4 g hh gồm Mg, Zn, Al vào dung dịch có chứa 34,675 g HCl. Chứng minh hh kim loại bị tan hết

Những câu hỏi liên quan
Khi đốt 18.4 g hh Zn và Al thì cần 5.6 lít khí oxi ( đktc) a) Tính % khối lượng hh ban đầu b) Nếu cho 9.2 g hh kim loại vào dung dịch HCl thì thu được bao nhiêu lít khí H2 (đktc) ?
Xem chi tiết
cho 5,6g hỗn hợp Mg, Zn, Al tác dụng với dung dịch có chứa 25,55g HCl. hỗn hợp kim loại có bị hòa tan hết không. vì sao
\(n_{HCl} = \dfrac{25,55}{36,5} = 0,7(mol)\\ M_{Mg} = 24 < M_{Al} = 27 < M_{Zn} = 65\\ \Rightarrow n_{\text{hỗn hợp max}} = n_{Mg} = \dfrac{5,6}{24} = \dfrac{7}{30}(mol)\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{HCl\ pư} = 2n_{Mg} = \dfrac{7}{15} = 0,467 < 0,7\\ \Rightarrow \text{Kim loại tan hết}\)
Đúng 1
Bình luận (0)
Cho hh A gồm bột của 3 KL: Al, Zn, Mg. Cho 28,6 g hh A tác dụng hết với oxygen (dư) được 44,6 g hỗn hợp oxide B. Hòa tan hoàn toàn hh B trong dd HCl (dư) được dd D. Cô cạn dd D thu được bao nhiêu g muối khan?
\(2\left[H\right]+\left[O\right]->H_2O\\ n_{Cl}=n_H=2n_O=\dfrac{44,6-28,6}{16}.2=2mol\\ m_{muoi}=28,6+35,5.2=99,6g\)
Đúng 3
Bình luận (0)
Cho 23,676 g hh 3 kim loại Mg, Al, Cu tác dụng hết với O2, thu được 34,14 g hh gồm 3 oxi. Hỏi để hoà tan hết lượng hh oxit đó cần ít nhất bao nhiêu ml dd 2 axit HCl 3M và H2SO4 1,5 M.
Giúp mình với!
2Mg+O2 -t°->2MgO(1)
4Al+3O2 - t°->2Al2O3( 2)
2Cu+O2 - t°->2CuO(3)
MgO+2HClàMgCl2+H2O(4)
Al2O3+6HClà2AlCl3+3H2O(5)
CuO+2HClà CuCl2+H2O(6)
MgO+H2SO4àMgSO4+H2O(7)
Al2O3+3H2SO4àAl2(SO4)3+3H2O(8)
CuO+H2SO4àCuSO4+H2O(9)
-∑mO=34,14-23,676=10,464(g)<->0,654(mol)
-Theo pt(4,5,6,7,8,9):nH=2nO=2*0,654=1,308(mol)
Đặt V axit=V(l)
=>nHCl=3V;nH2SO4=1,5V
Ta có: ∑nH=3V + 1,5V*2=1,308
=>V=0,218(l)=218ml
Đúng 0
Bình luận (0)
cho m gam hh Mg,Al tác dụng với dung dịch có chứa 21,9 gam HCL . sau phản ứng thu được 11,2 lít khí .CMR sau phản ứng kim loại tan hết
Bài 1 hòa tan hoàn toàn 8,68 g hh Fe , Mg .Zn cần dùng hết 160ml đ HCl 2M
a Tính thể tích của H2 sinh ra
b Cô cạn dd sau pứ thì thu đc bao nhiêu g muối than
bài 2 Cho 7,8 g hh kim loại Al và Mg tác dụng với HCl thu đ 8,96 lít H2 ở đktc . Hỏi khi cô cạn dd thu đc bao nhiêu g muối than
Bài 3 Hòa tan hoàn toàn 11,8 g hh X gồm Fe, Mg và Al 1 lượng vừa đủ đ HCl loãng thu đ 11,2 lít H2 đktc và dd chứa m gam muối Tính m
Đọc tiếp
Bài 1 hòa tan hoàn toàn 8,68 g hh Fe , Mg .Zn cần dùng hết 160ml đ HCl 2M
a Tính thể tích của H2 sinh ra
b Cô cạn dd sau pứ thì thu đc bao nhiêu g muối than
bài 2 Cho 7,8 g hh kim loại Al và Mg tác dụng với HCl thu đ 8,96 lít H2 ở đktc . Hỏi khi cô cạn dd thu đc bao nhiêu g muối than
Bài 3 Hòa tan hoàn toàn 11,8 g hh X gồm Fe, Mg và Al = 1 lượng vừa đủ đ HCl loãng thu đ 11,2 lít H2 đktc và dd chứa m gam muối Tính m
Bài 2:
2Al+6HCl-->2AlCl3+3H2
Mg+2HCl-->MgCl2+H2
Theo PT trên cứ 2mol HCl tạo ra 1 mol H2
=>nHCl=nH2.2=0.4.2=0.8mol
=>mHCl=36.5.0.8=29.2g
mH2=0.4.2=0.8g
Áp dụng ĐL bảo toàn KL ta có:
mhhKL+mHCl=m muối+mH2
=> muối=7.8+29.2-0.8=36.2g
Vậy KL muối khan thu đc là 36.2 g.
Đúng 0
Bình luận (0)
Bài 2:
\(n_{H_2}=0,4mol\)
\(n_{HCl}=2n_{H_2}=0,8mol\)(2 phân tử HCl tạo 1 phân tử H2)
\(n_{Cl}=n_{HCl}=0,8mol\)
mmuối=mKim loại+mCl=7,8+0,8.35,5=36,2g
Đúng 0
Bình luận (0)
Bài 1:
\(n_{HCl}=0,32mol\)
2 phân tử HCl tạo 1 phân tử H2 nên:
\(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,16mol\)
\(V_{H_2}=0,16.22,4=3,584l\)
nCl=nHCl=0,32mol
mmuối=mkim loại+mCl=8,68+0,32.35,5=20,04g
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
cho 5,6g al,mg,zn vào dd chứa 2,5mol hcl. chứng minh hh rắn không tan
Cho 13g hh A gồm Fe , Mg và Zn PƯ vs 1,2 mol HCl
a, Chứng tỏ A tan hết
b, Nếu tổng số mol của 3 kim loại trong 13g hh A là 0,3 mol , tỉ lệ số mol giữa Fe và Mg là 1:1 . Tính khối lượng mỗi kim loại trong hh
Để hoà tan hết 7,8 g hh A gồm hai kim loại Al và Mg cầm vừa đủ 39,2 g H2SO4.Xác định % klg mỗi kim loại trong hh ban đầu
2Al+3H2SO4--->Al2(SO4)3+3H2
x------1,5x
Mg+H2SO4----->MgSO4+H2
y-----y
n\(_{H2SO4}=\frac{39,2}{98}=0,4\left(mol\right)\)
Theo bài ra ta có pt
\(\left\{{}\begin{matrix}27x+24y=7,8\\1,5x+y=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
%m\(_{Al}=\frac{0,2.27}{7,8}.100\%=69,23\%\)
%m\(_{Mg}=100-69,23=30,77\%\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời