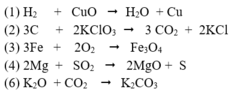I. Hoàn thành các phương trình phản ứng sau:
1. CH3COONa + NaOH underrightarrow{CaO,t^o}
2. CH4 underrightarrow{1500^oC}
3. C2H2 + H2 underrightarrow{Pd/PbCO_3,t^o}
4. C2H2 + H2O underrightarrow{HgSO_4.H_2SO_4}
II. Cho sơ đồ phản ứng:
X underrightarrow{left(1right)} CH3CHO underrightarrow{left(2right)} CH3COOH underrightarrow{left(3right)} CO2
1. Xác định X
2. Viết các phương trình phản ứng xảy ra (Biết mỗi mũi tên ứng với 01 phản ứng)
III. Hỗn hợp X gồm etilen và axetilen. Cho m gam X...
Đọc tiếp
I. Hoàn thành các phương trình phản ứng sau:
1. CH3COONa + NaOH \(\underrightarrow{CaO,t^o}\)
2. CH4 \(\underrightarrow{1500^oC}\)
3. C2H2 + H2 \(\underrightarrow{Pd/PbCO_3,t^o}\)
4. C2H2 + H2O \(\underrightarrow{HgSO_4.H_2SO_4}\)
II. Cho sơ đồ phản ứng:
X \(\underrightarrow{\left(1\right)}\) CH3CHO \(\underrightarrow{\left(2\right)}\) CH3COOH \(\underrightarrow{\left(3\right)}\) CO2
1. Xác định X
2. Viết các phương trình phản ứng xảy ra (Biết mỗi mũi tên ứng với 01 phản ứng)
III. Hỗn hợp X gồm etilen và axetilen. Cho m gam X qua dung dịch brom dư thấy có 200ml dung dịch Br2 2M phản ứng. Mặt khác nếu cho m gam X phản ứng hoàn toàn với lượng AgNH3/NH3 dư thì sau phản ứng thu được 24 gam kết tủa. Tính m gam hỗn hợp X ban đầu.
IV. Hỗn hợp X gồm axit fomic và anđehit fomic. Cho m gam X phản ứng với Na dư thu được 2,24 lít khí thoát ra (đo ở đktc). Mặt khác nếu cũng lượng X trên nhưng cho phản ứng hoàn toàn với lượng AgNH3/NH3 dư thì sau phản ứng thu được 64,8 gam kết tủa. Tính khối lượng của hỗn hợp X ban đầu.
Giải giúp mình nhé. Mai mình thi HKII rồi. Cảm ơn các bạn rất nhiều.