Hãy cho biết số mol của các chất sau:
a) 4 g cacbon ; 62 g photpho ; 42 g sắt.
b) 3,6 g nước ; 95,48 g khí cacbonic ; 14,625 g muối ăn.
c) 8,96 lít O2 (đktc); 5,6 lít H2 (đktc); 12 lít CO ( đk thường)
Bài 6: Hãy tính số mol của các lượng chất sau:
a/ 14 g canxi oxit ( CaO )
b/ 3.1023 nguyên tử cacbon ( C )
c/ 9.1023 phân tử nước ( H2O )
d/ 16 g khí Oxi ( O2 )
Biết C = 12 ; O = 16 ; Ca = 40 ; H = 1
\(a,n_{CaO}=\dfrac{14}{40}=0,35(mol)\\ b,n_{C}=\dfrac{3.10^{-23}}{6.10^{-23}}=0,5(mol)\\ c,n_{H_2O}=\dfrac{9.10^{-23}}{6.10^{-23}}=1,5(mol)\\ d,n_{O_2}=\dfrac{16}{32}=0,5(mol)\)
3. Hãy cho biết số nguyên tử hoặc phân tử có trong những lượng chất sau:
a. 0,1mol nguyên tử H
b. 10 mol phân tử H2O
c. 0,25 mol phân tử CH4
4. Hãy xác định khối lượng mol của những lượng chất sau:
a. 1 mol phân tử CuO
b. 1 mol phân tử Fe2(SO4)3
c. N phân tử C2H2
5. Hợp chất đồng (II) sunfat có phân tử gồm 1Cu, 1S, 4O.
a. Tìm CTHH của hợp chất trên.
b. Tính khối lượng mol của phân tử trên.
c. Tính số mol nguyên tử đồng và nguyên tử oxi có trong 1mol phân tử đồng (II) sunfat.
Bài 3:
\(a,Số.nguyên.tử.H=0,1.6.10^{23}=6.10^{22}\) ( nguyên tử )
\(b,Số.phân.tử.H_2O=10.6.10^{23}=6.10^{24}\left(phân.tử\right)\)
\(c,Số.phân.tử.CH_4=0,25.6.10^{23}=1,5.10^{23}\left(phân.tử\right)\)
Bài 4:
a, \(M_{CuO}=64+16=80\left(\dfrac{g}{mol}\right)\)
\(b,M_{Fe_2\left(SO_4\right)_3}=56.2+32.3+16.12=400\left(\dfrac{g}{mol}\right)\)
\(c,M_{C_2H_2}=12.2+1.2=26\left(\dfrac{g}{mol}\right)\)
< Bài này bạn xem lại đề giúp mình nhé! Thấy nó cho ko hợp lí == >
Bài 5:
a, CTHH: CuSO4
b, \(M_{CuSO_4}=64+32+16.4=160\left(\dfrac{g}{mol}\right)\)
c, \(n_{Cu}=\dfrac{64}{64}=1mol\\ n_O=\dfrac{16.4}{16}=4mol\)
Hãy cho biết khối lượng của các chất sau:
a) 3N phân tử NaCl
b) 0,05 mol phân tử đường glucozơ C6H12O6
a. Ta có: \(n_{NaCl}=3N_{NaCl}=3\left(mol\right)\)
\(\Rightarrow m_{NaCl}=3.58,5=175,5\left(g\right)\)
b. \(m_{C_6H_{12}O_6}=0,05.180=9\left(g\right)\)
Hãy cho biết số mol của những khối lượng chất sau: 4g cacbon; 62g photpho; 42g sắt
Bằng phương pháp hóa học hãy nhận biết các chất sau:
a) Rượu etylic, axit axetic, dầu ăn tan trong rượu etylic.
b) Khí metan, etilen, cacbon đioxit.
a)
-Dùng quỳ tím để nhận biết ra axit axetic.
-Hai chất lỏng còn lại cho vào ống nghiệm đựng nước, chất nào tan hoàn toàn tạo thành hỗn hợp đồng chất là rượu etylic, chất nào không tan nổi lên trên, hỗn hợp tách thành hai lớp riêng biệt là dầu ăn.
b)
lấy mẫu thử và đánh dấu
- cho dung dịch nước vôi trong ( Ca(OH)2) vào các mẫu thử
+ mẫu thử nào xuất hiên kết tủa trắng -> CO2
CO2 + Ca(OH)2 -> CaCO3 + H2O
+ mẫu thử nào khong hiện tượng -> CH4 và C2H4 (1)
- dẫn mẫu thử nhóm (1) qua dung dịch brom
+ mẫu thử nào làm mất màu dd -> C2H4
C2H4 + Br2 -> C2H4Br2
- còn lại là CH4
a) Cho các chất hoà vào nước:
- Tan hết: C2H5OH
Tan không hết: CH3COOH
- Không tan: dầu ăn
b)
Dẫn qua dd Ca(OH)2 dư:
- Có kết tủa trắng: CO2
CO2 + Ca(OH)2 ---> CaCO3 + H2O
- Không hiện tượng: C2H4. CH4 (1)
Dẫn (1) qua dd Br2 dư:
- Mất màu Br2: C2H4
C2H2 + 2Br2 ---> C2H4Br2
- Không hiện tượng: CH4
bài 1: hợp chất A có tỉ khối so với H2 là 22. Hãy cho biết 5,6 lít khí A ở(đktc) có khối lượng là bao nhiêu gam?
bài 2: tìm công thữ hóa học của những hợp chất có thành phần nguyên tố như sau:
a) hợp chất A tạo bởi 2 nguyên tố: C và O có khối lượng mol là 44(g?mol),trong đó cacbon chiếm 27,3% về khối lượng,còn lại là % O
b) hợp chất B tạo bởi 3 nguyên tố: Na,C,O có khối lượng mol là 44(g/mol), thành phần các nguyên tố lần lượt là: 43,4% Na,11,3% C,45,3%
c) một hợp chất khí A có thành phần % theo khối lượng: 82,35% N,17,65% H. Hợp chất A có tỉ khối với H2 là 8,5. Hãy cho biết:
- CTHH của hợp chất A
- số mol nguyên tử của các nguyên tố có trong 0,5 mol hợp chất A.
bài1
ta có dA/H2=22 →MA=22MH2=22 \(\times\) 2 =44
nA=\(\frac{5,6}{22,4}\)=0,25
\(\Rightarrow\)mA=M\(\times\)n=11 g
MA=dA/\(H_2\)×M\(H_2\)=22×(1×2)=44g/mol
nA=VA÷22,4=5,6÷22,4=0,25mol
mA=nA×MA=0,25×44=11g
a)
MC=27,3×44÷100\(\approx\)12g/mol
% mO=100-27,3=72,7%
MO=72,7×44÷100\(\approx\)32g/mol
Công thức hóa học chung: CaxOy
Theo công thức hóa học có:
x×\(III\)=y×\(IV\)
Lập tỉ lệ: \(\dfrac{x}{y}=\dfrac{II}{IV}=\dfrac{2}{4}=\dfrac{1}{2}\)
=>x=1 và y=2
Công thức hóa học của hợp chất: CO\(_2\)
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học.
b) Nếu muốn đốt cháy 20 mol CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất?
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 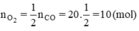
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
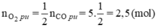 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |
Bài 1: Em hãy cho biết số mol nguyên tử hoặc phân tử có trong mỗilượng chất sau:a. 0,25 mol CuSO4 c. 5 mol AlO3, c. 0,3 mol K2SO4 d. 0,125 mol Ca(OH) 2
a, \(Spt_{CuSO_4}=0,25.6,10^{23}=1,5.10^{23}\) (spt là số phân tử)
b, \(Spt_{Al_2O_3}=5.6,10^{23}=3.10^{24}\)
c, \(Spt_{K_2SO_4}=0,3.6,10^{23}=1,8.10^{23}\)
d, \(Spt_{Ca\left(OH\right)_2}=0,125.6,10^{23}=7,5.10^{22}\)
1.Tính thành phần phần trăm (theo khối lượng) của các nguyên tố hóa học có mặt trong các hợp chất sau:
a) Fe(NO3)2, Fe(NO3)2
b) N2O, NO, NO2
2.Hãy tìm công thức hóa học của chất X có khối lượng mol MX = 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.
3.Lập công thức hóa học của hợp chất A biết:
- Phân khối của hợp chất là 160 đvC
-Trong hợp chất có 70% theo khối lượng sắt, còn lại là oxi.
Câu 2:
Trong 1 mol X: \(\left\{{}\begin{matrix}n_{Ag}=\dfrac{170.63,53\%}{108}=1\left(mol\right)\\n_N=\dfrac{170.8,23\%}{14}=1\left(mol\right)\\n_O=\dfrac{170\left(100\%-63,53\%-8,23\%\right)}{16}=3\left(mol\right)\end{matrix}\right.\)
Vậy CTHH của X là \(AgNO_3\)
Câu 1:
\(a,\%_{Fe}=\dfrac{56}{180}\cdot100\%=31,11\%\\ \%_N=\dfrac{14\cdot2}{180}\cdot10\%=15,56\%\\ \%_O=100\%-31,11\%-15,56\%=53,33\%\\ b,\%_{N\left(N_2O\right)}=\dfrac{14\cdot2}{44}\cdot100\%=63,63\%\\ \%_{O\left(N_2O\right)}=100\%-63,63\%=36,37\%\\ \%_{N\left(NO\right)}=\dfrac{14}{30}\cdot100\%=46,67\%\\ \%_{O\left(NO\right)}=100\%-46,67\%=53,33\%\\ \%_{O\left(NO_2\right)}=\dfrac{16\cdot2}{46}\cdot100\%=69,57\%\\ \%_{N\left(NO_2\right)}=100\%-69,57\%=30,43\%\)