Cho 21,0(g) Fe2 + 4,48(l) H2 a, Chất nào dư, dự bao nhiêu b,mFe thu được

Những câu hỏi liên quan
Cho 22,4g Fe tác dụng với dung dịch loãng có chứa 24,5 g H2SO4 sau phản ứng hãy cho biết: a, Chất nào dư sau phản ứng và dư bao nhiêu gam? b, Tính thể tích H2 thu được ở đktc. Có đc ghi fe +h2so4--->fe2(so4)3 +h2 đc ko ạ
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,25` `0,25` `0,25` `(mol)`
`a)n_[Fe]=[22,4]/56=0,4(mol)`
`n_[H_2 SO_4]=[24,5]/98=0,25(mol)`
Có: `[0,4]/1 > [0,25]/1=>Fe` hết, `H_2 SO_4`
`=>m_[Fe(dư)]=(0,4-0,25).56=8,4(g)`
`b)V_[H_2]=0,25.22,4=5,6(l)`
Ko được ghi `Fe+H_2 SO_4->Fe_2 (SO_4)_3+H_2` vì đây là `H_2 SO_4` loãng
Đúng 4
Bình luận (2)
cho a g bột al vào 100ml dd fe2(so4)3 0,4M và cuso4 1,2M, sau phản ứng thu được b g rắn X. cho X tấc dụng với hcl dư thu được 4,48 lít h2 ở đktc. tổng a+b là: A. 25,5g B. 20,8g C. 24,69g D. 25,14g
nCu2+ =0,12 mol
nFe3+ =0,08 mol
nH2=0,2 mol
Dễ thấy Pứ này Al dư, hỗn hợp X gồm Cu, Fe và Al dư vì
nH2*2> nFe*2 => Al còn dư => Fe3+ và Cu2+ hết
Ta có PTrinh e: nH2*2 =nAl*3 + nFe*2
<=>0,2*2=nAl*3+0,08*2 => nAl dư=0,08 mol
=> mX=b=mCu + mFe + mAl dư= 0,12*64+0,08*56+0.08*27= 14,32g
Áp dụng đl bảo toàn e ta có
nAl*3 =nCu*2 + nFe*3 =0,12*2+0,08*3=>nAl=0,16 mol
=> nAl ban đầu =0,16+0.08=0,24 mol
=>a=mAl=6,48 g
=> a+b = 6,48 + 14,32= 20,8 gam
bài : cho 4,48(l) khí h2 tác dụng với 23,2g f2o3 đun nóng
a) chất nào còn dư phản ứng . Khối Lượng chất dư là bao nhiêu ?
b) tính khối lượng chất rắn thu đc sau phản ứng
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{4,48}{22,4}=0,2mol\)
\(n_{Fe_2O_3}=\dfrac{m_{Fe_2O_3}}{M_{Fe_2O_3}}=\dfrac{23,2}{160}=0,145mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,145 > 0,2 ( mol )
1/15 0,2 2/15 ( mol 0
Chất còn dư là \(Fe_2O_3\)
\(m_{Fe_2O_3\left(du\right)}=n_{Fe_2O_3\left(du\right)}.M_{Fe_2O_3}=\left(0,145-\dfrac{1}{15}\right).160=12,53g\)
\(m_{Fe}=n_{Fe}.M_{Fe}=\dfrac{2}{15}.56=7,4666g\)
Đúng 2
Bình luận (0)
Cho 5,6 (g) Fe +3,65 (g) Hcl thu được muối FeCl2 +H2. Hỏi
A,Chất nào dư ?dư bao nhiêu gram
B,Tính VH2(dkk)
Xem chi tiết
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
a, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
\(\Rightarrow m_{Fe\left(dư\right)}=0,05.56=2,8\left(g\right)\)
b, Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\) \(\Rightarrow\) HCl phản ứng hết, Fe còn dư
\(\Rightarrow n_{Fe\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\) \(\Rightarrow m_{Fe\left(dư\right)}=0,05\cdot56=2,8\left(g\right)\)
b) Theo PTHH: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,05mol\)
\(\Rightarrow V_{H_2}=0,05\cdot22,4=1,12\left(l\right)\)
Đúng 1
Bình luận (0)
cho 80g Fe2O3 tác dụng với 67,2 l khí H2 (đktc)
a/sau phản ứng chất còn dư và dư bao nhiêu gam
b/ Tính mFE tạo thành
cảm ơn mn
\(a,n_{Fe_2O_3}=\dfrac{80}{160}=0,5\left(mol\right)\\ n_{H_2}=\dfrac{67,2}{22,4}=3\left(mol\right)\)
PTHH: \(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Trước: 0,5 3
Trong; 0,5 1,5 1
Sau: 0 1,5 1
Vì \(\dfrac{0,5}{1}< \dfrac{3}{3}\) nên H2 dư
\(m_{H_2\left(dư\right)}=1,5.2=3\left(g\right)\)
b, \(m_{Fe}=56.1=56\left(g\right)\)
Đúng 4
Bình luận (0)
nFe2O3 = 80 : 160 = 0,5 (mol)
nH2 = 67,2 : 22,4 =3 (mol)
pthh : Fe2O3 + 3H2 -t--> 4Fe + 3H2O
LTL
0,5/1 < 3/3 => H2 du
theo pt , nFe = 4nFe2O3 = 2 (mol)
=> mFe = 2 .56 = 112 (g)
Đúng 0
Bình luận (0)
7/ Cho 13g Zn tác dụng với dd HCl có chứa14,6g.a/ Tính thể tích H2 thu được (đktc)?b/ Chất nào còn dư và dư bao nhiêu g?8/ Có một cốc đựng dd H2SO4 (l) . Lúc đầu người ta cho một lương bột nhôm vào dd axit , PƯ xong thu được 6,72(l) H2 (ơ đktc). Sau đó thêm tiếp vào dd đó một lượng bột kẽm dư , PƯ xong thu them được 4,48(l) H2 nữa.a/ Viết phương trình hóa học của phản ứng?b/ Tính khối lượng bột nhôm, bột kẽm PƯ?c/ Tính khối lượng axit H2SO4 có trong dd ban đầu?c/ Hợp chất tạo thành sau PƯ trên...
Đọc tiếp
7/ Cho 13g Zn tác dụng với dd HCl có chứa14,6g.
a/ Tính thể tích H2 thu được (đktc)?
b/ Chất nào còn dư và dư bao nhiêu g?
8/ Có một cốc đựng dd H2SO4 (l) . Lúc đầu người ta cho một lương bột nhôm vào dd axit , PƯ xong thu được 6,72(l) H2 (ơ đktc). Sau đó thêm tiếp vào dd đó một lượng bột kẽm dư , PƯ xong thu them được 4,48(l) H2 nữa.
a/ Viết phương trình hóa học của phản ứng?
b/ Tính khối lượng bột nhôm, bột kẽm PƯ?
c/ Tính khối lượng axit H2SO4 có trong dd ban đầu?
c/ Hợp chất tạo thành sau PƯ trên thuộc loại nào? Khối lượng của chúng là bao nhiêu?
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
\(pthh:Zn+2HCl->ZnCl_2+H_2\)
LTL :
\(\dfrac{0,2}{1}=\dfrac{0,4}{2}\)
=> ko chất nào dư
theo pthh : \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\\
=>V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
Bài 8 (bài 7 bạn ở trên làm rồi)
\(n_{H_2\left(Al\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{H_2\left(Zn\right)}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
0,2 0,3 0,1 0,3
Zn + H2SO4 ---> ZnSO4 + H2
0,3 0,3 0,3 0,3
\(a,\left\{{}\begin{matrix}m_{Al}=0,3.27=8,1\left(g\right)\\m_{Zn}=0,3.65=19,5\left(g\right)\end{matrix}\right.\\ b,m_{H_2SO_4}=\left(0,3+0,3\right).98=58,8\left(g\right)\)
c, Hợp chất tạo thành thuộc loại muối trung hoà
mmuôí = 0,1.342 + 0,3.161 = 82,5 (g)
Đúng 1
Bình luận (0)
\(pthh:\left\{{}\begin{matrix}Al+3H_2SO_4->Al_2\left(SO_{\text{4}}\right)_3+3H_2\left(1\right)\\Zn+H_2SO_4->ZnSO_4+H_2\left(2\right)\end{matrix}\right.\)
\(n_{H_2\left(1\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\
n_{H_2\left(2\right)}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
=>\(m_{Al}=0,3.27=8,1\left(mol\right)\\
n_{Zn}=0,2.65=13\left(g\right)\)
\(\Sigma n_{H_2SO_4}=0,3+0,2=0,5\left(mol\right)\\
=>\Sigma m_{H_2SO_4}=0,5.98=49\left(g\right)\)
=>\(\left\{{}\begin{matrix}m_{Al_2\left(SO\right)_4}=342.0,1=34,2\left(G\right)\left(mu\text{ối}\right)\\m_{ZnSO_4}=0,2.161=32,2\left(g\right)\left(mu\text{ối}\right)\end{matrix}\right.\)
Cho 4,6 g Na tác dụng với 4,48 lít khí Cl2 ở điều kiện tiêu chuẩn thu được m gam muối NaCl
a, Chất nào dư và dư bao nhiêu gam
b, Tính khối lượng muối thu được bnhiu
(biết a = 23 CL = 3,35)
\(a,n_{Na}=\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\\ n_{Cl_2}=\dfrac{V_{Cl_2\left(đktc\right)}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ PTHH:2Na+Cl_2\rightarrow2NaCl\\ Vì:\dfrac{0,2}{2}< \dfrac{0,2}{1}\Rightarrow Cl_2dư\\ \Rightarrow n_{Cl_2\left(dư\right)}=0,2-\dfrac{0,2}{2}=0,1\left(mol\right)\\ \Rightarrow m_{Cl_2\left(dư\right)}=0,1.71=7,1\left(g\right)\\ b,n_{NaCl}=n_{Na}=0,2\left(mol\right)\\ \Rightarrow m_{NaCl}=58,5.0,2=11,7\left(g\right)\)
Đúng 6
Bình luận (0)
Chất hữu cơ A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức.Cho 0,9 g chất A tác dụng với lượng dư dung dịch
A
g
N
O
3
trong amoniac, thu được 5,4 g Ag.Cho 0,2 mol A tác dụng với
H
2
có dư ( xúc tác Ni nhiệt độ ) ta được ancol B. Cho ancol B tác dụng với Na ( lấy dư ) thu được 4,48 lít
H
2
(đktc).Xác định công thức và tên chất A...
Đọc tiếp
Chất hữu cơ A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức.
Cho 0,9 g chất A tác dụng với lượng dư dung dịch A g N O 3 trong amoniac, thu được 5,4 g Ag.
Cho 0,2 mol A tác dụng với H 2 có dư ( xúc tác Ni nhiệt độ ) ta được ancol B. Cho ancol B tác dụng với Na ( lấy dư ) thu được 4,48 lít H 2 (đktc).
Xác định công thức và tên chất A.
A tác dụng với dung dịch A g N O 3 trong amoniac tạo ra Ag; vậy A có chức anđehit.
0,2 mol anđehit kết hợp với hiđro phải tạo ra 0,2 mol ancol B có công thức R ( C H 2 O H ) x
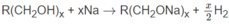
Theo phương trình 1 mol B tạo ra x/2 mol H 2
Theo đầu bài 0,2 mol B tạo ra 0,2 mol H 2
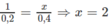
Vậy B là ancol hai chức và A là anđehit hai chức.
R ( C H O ) 2 + 4 A g N O 3 + 6 N H 3 + 2 H 2 O → R ( C O O N H 4 ) 2 + 4 N H 4 N O 3 + 4Ag↓
Số mol anđehit A = (x/4)số mol Ag 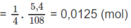
Khối lượng 1 mol A 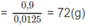
R ( C H O ) 2 = 72
⇒ R = 72 - 2.29 = 14. Vậy R là C H 2
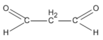 (propanđial)
(propanđial)
Đúng 0
Bình luận (0)
Đốt cháy 28g Fe trong 4,48 (lít) O2 ( đktc)
a) Chất nào còn dư và dư bao nhiêu
b) Tính khối lượng Oxit thu được
\(n_{Fe}=\dfrac{28}{56}=0.5\left(mol\right)\)
\(n_{O_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(Bđ:0.5....0.2\)
\(Pư:0.3.....0.2........0.1\)
\(Kt:0.2.......0..........0.1\)
\(m_{Fe\left(dư\right)}=0.2\cdot56=11.2\left(g\right)\)
\(m_{Fe_3O_4}=0.1\cdot232=23.2\left(g\right)\)
Đúng 2
Bình luận (2)




























