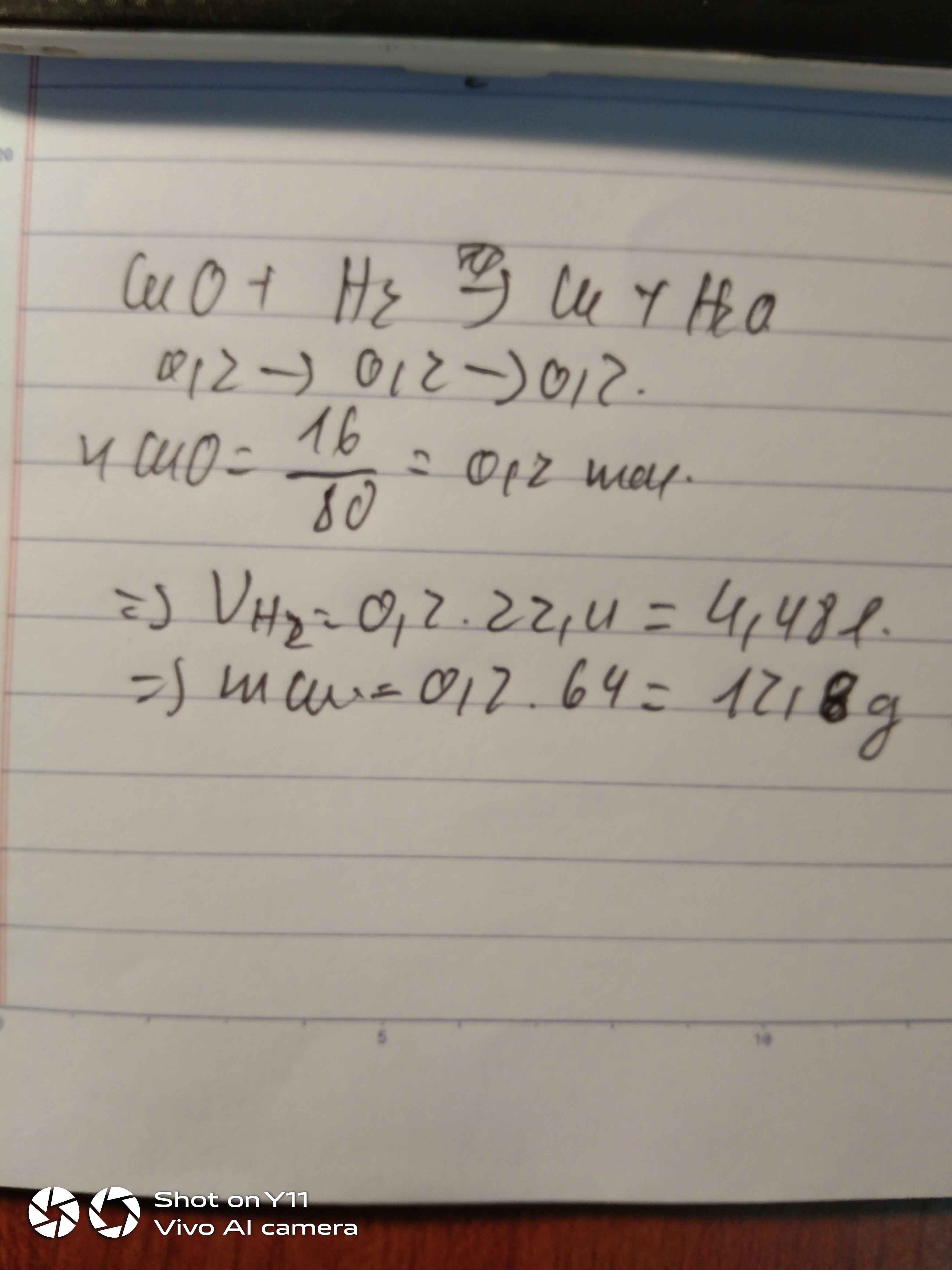Khử 8g Copper (II) oxide bằng khí hidrogen, vt pt
Tuyển Cộng tác viên Hoc24 nhiệm kì 26 tại đây: https://forms.gle/dK3zGK3LHFrgvTkJ6

Những câu hỏi liên quan
Khử 8g Copper (II) oxide bằng khí hidrogen, vt pt và tính khối lượng kim loại thu được
giải thích hiện tượng khí hydrogen khử copper (II) oxide
- Chất rắn màu đen chuyển dần sang màu đỏ, có hơi nước xuất hiện:
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Đúng 2
Bình luận (0)
Khử 28,8 gam copper (II) oxide bằng khí hydrogen
a) Tính thể tích khí hydrogen cần dùng ở đkc
b) TÍnh khối lượng kim loại đồng tạo thành ( Cu=64, O=16, H=1)
ncu = 28,8/64 = 0,45 mol
CuO + H2 -> Cu + H2O
1 : 1 : 1 : 1
0,45mol
a) nH2 = (0,45.1) : 1 = 0,45 mol
VH2 = 0,45 . 22,4 = 10,08 ( l )
b) mCu = 0,45 . 64 = 28,8 ( g)
CuO+H2-to>Cu+H2O
0,36---0,36----0,36
n CuO=\(\dfrac{28,8}{80}\)=0,36 mol
=>VH2=0,36.22,4=8,064l
=>m Cu=0,36.64=23,04g
Đúng 1
Bình luận (0)
a. \(n_{Cu}=\dfrac{28.8}{64}=0,45\left(mol\right)\)
PTHH : CuO + H2 -> Cu + H2O
0,45 0,45 0,45 0,45
\(V_{H_2}=0,45.22,4=10,08\left(l\right)\)
b. \(m_{Cu}=0,45.64=28,8\left(g\right)\)
Đúng 1
Bình luận (1)
Khử 16g Copper(II) oxide (CuO ) bằng khí hydrogen (H2 ) a.Tính thể tích khí hydrogen (H2 ) tham gia phản ứng? b. Tính khối lượng kim loại tạo thành? Fe= 56, O=16, Cu=64, H=1
cho 7,2g Mg tan hoàn toàn trong dung dịch hydrochloric acid HCl.
a. Tính thể tích khí hydrogen sinh ra (đkc)
b. Tính khối lượng HCl tham gia phản ứng
c. Dẫn khí hydrogen vừa tạo thành đi qua 12g copper (II) oxide (CuO). Khí Hydrogen có khử hết copper (II) oxide CuO không?
giải giúp em câu c vớii ạ
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
PTHH:
Mg + 2HCl ---> MgCl2 + H2
0,3-->0,6----------------->0,3
=> \(\left\{{}\begin{matrix}V_{H_2}=24,79.0,3=7,437\left(l\right)\\m_{HCl}=0,6.36,5=21,9\left(g\right)\end{matrix}\right.\)
\(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,15 < 0,3 => H2 dư, vậy H2 khử hết CuO
Đúng 2
Bình luận (1)
a, \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Mg + 2HCl -----> MgCl2 + H2
0,3 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
c, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
CuO + H2 -----> Cu + H2O
Ta có: \(\dfrac{0,15}{1}< \dfrac{0,3}{1}\) ⇒ CuO hết, H2 dư
Đúng 1
Bình luận (1)
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,3 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72l\\
m_{HCl}=0,6.36,5=21,9g\\
n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(ltl:0,15< 0,3\)
=> H2 có khử hết CuO
Đúng 1
Bình luận (0)
Khử 12g copper(II)oxide (CuO) trong không khí H2(phản ứng xảy ra hoàn toàn)
A)viết pthh
B)tính khối lượng các sản phẩm tạo thành
C)tính thể tính khí H2(đkc)
Cu=64; O=16; H=1
a, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Cu}=n_{H_2O}=n_{CuO}=0,15\left(mol\right)\)
b, \(m_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{H_2O}=0,15.18=2,7\left(g\right)\)
c, \(V_{H_2}=0,15.24,79=3,7185\left(l\right)\)
Đúng 2
Bình luận (0)
Viết PTHH biểu diễn các thí nghiệm sau:
a.nhiệt phân KClO3 với xúc tác MnO2 để điều chế khí oxygen
b.oxygen hóa iron
c.khí hydrogen khử copper(II) oxide CuO ở 400 độ C
d.hòa tan CaO vào nước
\(2KClO_3\xrightarrow[xtMnO_2]{t^o}2KCl+3O_2\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\
H_2+CuO\underrightarrow{400^oC}H_2O+Cu\\
CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Đúng 3
Bình luận (0)
Cho 4g copper(II) oxide(CuO) tác dụng với khí hydrogen. Tạo ra 2g copper. Tính hiệu suất phản ứng
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\\ n_{Cu\left(LT\right)}=n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\\ n_{Cu\left(TT\right)}=\dfrac{2}{64}=0,03125\left(mol\right)\\ \Rightarrow H=\dfrac{0,03125}{0,05}.100\%=62,5\%\)
Đúng 3
Bình luận (0)
cho 7,2g Mg tan hoàn trong dd HCL.
a/Tính thể tích khí hydrogen sinh ra (đkc)
b/tính khối lượng HCL tham gia phản ứng
c/Dẫn khí hydrogen vừa tạo thành đi qua 12g copper (hóa trị 2) oxide (CuO).Khí hydrogen có khử hết copper hóa trị 2) oxide CuO không
Mg+2HCl->MgCl2+H2
0,3---0,6-----0,3----0,3
n Mg=0,3 mol
=>VH2=0,3.24,79=8,247 l
=>m HCl=0,6.36,5=21,9g
c)H2+CuO-to>Cu+H2O
0,15-----0,15
n CuO=0,15 mol
=>H2 dư -> CuO dheets
=>m Cu=0,15.64=9,6g
Đúng 3
Bình luận (0)