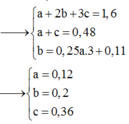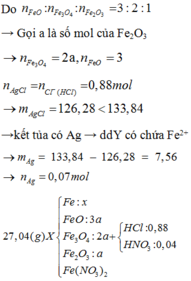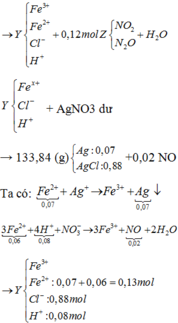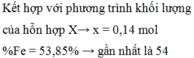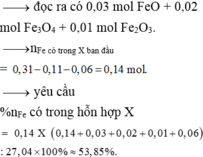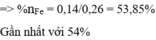một hỗn hợp X gồm Fe2O3 , Fe3O4 và FeO ( ỉ lệ mol FeO và Fe2O3 là 1:1 ) . khử hoàn toàn m gam X bằng khí H2 dư , kết thúc thì nghiệm thấy khối lượng chất rắn giảm 0,96g . viết phương trình hóa học

Những câu hỏi liên quan
Khử hoàn toàn m gam hỗn hợp X gồm FeO và Fe2O3 bằng H2 (dư), thu được 9 gam H2O và 22,4 gam chất rắn. Phần trăm số mol của FeO trong hỗn hợp X là:
A. 66,67.
B. 20,56.
C. 26,67.
D. 40,67.
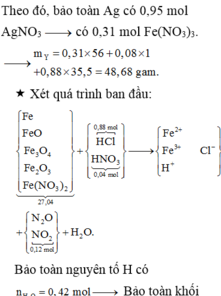
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỷ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm khối lượng của Fe có trong hỗn hợp ban...
Đọc tiếp
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỷ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm khối lượng của Fe có trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây?
A. 29%
B. 38%
C. 27%
D. 17%
Đáp án : A
Dd Y + dd AgNO3:
3Fe2+ + 4H+ + NO3 – → 3 Fe3+ + NO + 2H2O
0,06← 0,08← 0,02 ← 0,02
Kết tủa gồm AgCl và Ag. Trong đó: n AgCl = n HCl = 0,88 mol
=> m Ag = 133,84 – 0,88. 143,5 = 7,56 gam
=> n Ag = 0,07 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,07← 0,07 0,07 0,07
=> ∑ n Fe2+ (ddY) = 0,06 + 0,07 = 0,13 mol
n H+ dư (ddY) = 0,08 mol
=> dd Y gồm Fe+ ; Fe3+; H+ và Cl –
Bảo toàn điện tích trong dd có: 2 n Fe2+ + 3n Fe3+ + n H+ = n Cl –
<=> 3 n Fe3+ = 0,88 – 2. 0,13 – 0,08 = 0,54 mol
<=> n Fe3+ = 0,18 mol
Mặt khác, có ∑ n H+ bđ = 0,88 + 0,04 = 0,92 mol
=> n H+ p.ư = 2. n H2O = 0,84 mol
=> n H2O = 0,42 mol
X + HCl + HNO3 → Muối + axit dư + khí + H2O
(0,88 mol) (0,04 mol)
BTKL => m khí = 27,04 + 0,88. 36,5 + 0,04. 63 – 0,42. 18 – 0,31. 56 – 0,08 – 0,88. 35,5 = 5,44 gam
Gọi n N2O = x mol; n NO = y mol
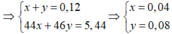
BT nguyên tố N: có n N [Fe(NO3)2] + n N(HNO3) = n N(sp khử)
=> 2. n Fe(NO3)2 + 0,04 = 0,04. 2 + 0,08 = 0,16
=> n Fe(NO3)2 = 0,06 mol
=> m Fe + m FeO + m Fe2O3 + m Fe3O4 (hhX) = 27,04 – 0,06. 180 = 16,24 gam (I)
Mặt khác, n FeO : Fe3O4 : n Fe2O3 = 3: 2: 1
=> Đặt n Fe2O3 = a => n Fe3O4 = 2a và n FeO = 3a
Đặt n Fe = b
Theo (I) => 56b + 840 a = 16,24 (1)
∑ n Fe(I) = 0,31 – 0,06 = 0,25 <=> b + 11a = 0,25 (2)
Từ (1) và (2) => a = 0,01 và b = 0,14 mol
=> % m Fe = (0,14. 56) : 27,04 = 28,99%
Đúng 0
Bình luận (0)
Cho a gam hỗn hợp X gồm Fe2O3, Fe3O4, Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp X bằng H2 dư, thu được 42 gam chất rắn. Tính % khối lượng Cu trong hỗn hợp X A. 25,6%. B. 50%. C. 44,8%. D. 32%.
Đọc tiếp
Cho a gam hỗn hợp X gồm Fe2O3, Fe3O4, Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp X bằng H2 dư, thu được 42 gam chất rắn. Tính % khối lượng Cu trong hỗn hợp X
A. 25,6%.
B. 50%.
C. 44,8%.
D. 32%.
Hòa tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4, Fe(OH)2 và Fe(OH)3 trong dung dịch chứa 1,6 mol HCl và 0,12 mol HNO3, thu được dung dịch X và hỗn hợp khí Y (gồm NO và H2 tỷ lệ mol 6:7). Nhúng thanh Fe (dư) vào dung dịch X thấy khối lượng thanh Fe giảm 13,44 gam. Cho AgNO3 dư vào X thấy xuất hiện 241,48 gam hỗn hợp kết tủa. Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình. Số mol Fe3+ có trong X là? A. 0,34 B. 0,36 C. 0,32 D. 0,38
Đọc tiếp
Hòa tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4, Fe(OH)2 và Fe(OH)3 trong dung dịch chứa 1,6 mol HCl và 0,12 mol HNO3, thu được dung dịch X và hỗn hợp khí Y (gồm NO và H2 tỷ lệ mol 6:7). Nhúng thanh Fe (dư) vào dung dịch X thấy khối lượng thanh Fe giảm 13,44 gam. Cho AgNO3 dư vào X thấy xuất hiện 241,48 gam hỗn hợp kết tủa. Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình. Số mol Fe3+ có trong X là?
A. 0,34
B. 0,36
C. 0,32
D. 0,38
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỷ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu...
Đọc tiếp
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỷ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với
A. 58%
B. 48%
C. 46%
D. 54%
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+ và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỷ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu...
Đọc tiếp
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+ và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỷ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với
A. 48%.
B. 58%.
C. 54%.
D. 46%.
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 :1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu...
Đọc tiếp
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 :1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với:
A. 48%.
B. 58%.
C. 54%.
D. 46%.
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu...
Đọc tiếp
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với
A. 54%.
B. 46%.
C. 58%.
D. 48%.
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu...
Đọc tiếp
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với
A. 54%.
B. 46%.
C. 58%.
D. 48%.
Dung dịch Y chứa Fe3+ (a); Fe2+ (b), Cl- (0,88) và nH+ dư = 4nNO = 0,88 (mol)
Bảo toàn điện tích: 3a + 2b + 0,08 = 0,88 (1)
nAgCl = 0,88 => nAg = 0,07 (mol)
Bảo toàn electron: b = 0,03.2 + 0,07 (2)
Từ (1) và (2) => a = 0,18 và b = 0,13 (mol)
Quy đổi hỗn hợp thành Fe ( 0,31 mol) ; O ( u mol) và NO3- ( v mol). Trong Z, đặt nN2O = x => nNO2 = 0,2 – x (mol)
=> 0,31.56 + 16u + 62v = 27,04 (3)
Bảo toàn nguyên tố N:
v + 0,04 = 2x + (0,12 –x) (4)
nH+ pư = 0,88 + 0,04 – 0,08 = 0,84
=> 10x + 2( 0,12 –x) + 2u = 0,84 (5)
Từ (3), (4), (5) => u = 0,14 ; v = 0,12 ; x = 0,04
nFe(NO3)2 = v/2 = 0,06 (mol)
Đặt k, 3h, 2h, h lần lượt là số mol Fe, FeO, Fe3O4, Fe2O3
Bảo toàn Fe: => 0,06 + k + 11h = 0,31 (6)
Bảo toàn O : => 14h = u = 0,14 (7)
Từ (6) và (7) => k = 0,14 (mol); h = 0,01 (mol)
Số mol hỗn hợp = 0,06 + k + 6h = 0,26
=> %nFe = 0,14/0,26 = 53,85%
Gần nhất với 54%
Đáp án A
Đúng 0
Bình luận (0)