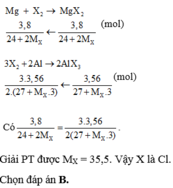cho 4.8l khí halogen x tác dụng với natri thu được 41.2 g muối halogenrua. tìm x ?

Những câu hỏi liên quan
cho 4.48l khí halogen x tác dụng với đồng thu được 27 g muối . tìm M?
\(Cu+X_2\rightarrow CuX_2\)
0.2mol\(\rightarrow\) 0.2 mol
\(n_{X_2}=\dfrac{V}{22.4}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(M_{CuX_2}=\dfrac{m}{n}=\dfrac{27}{0.2}=135\left(\dfrac{g}{mol}\right)\)
Mà \(M_{CuX_2}=M_{Cu}+M_{X_2}\)
\(\Leftrightarrow135=64+M_{X_2}\)
\(\Leftrightarrow M_{X_2}=71\)
Vậy\(X_2\) là Clo.
CTPT:\(CuCl_2\)
Đúng 1
Bình luận (0)
Câu 1: Cho 42,6 g muối natri của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 85,1 g hỗn hợp muối kết tủa. Xác định tên 2 muối halogen. Tính % khối lượng 2 muối trong hỗn hợp ban đầu.Câu 2: Cho 75,9 g muối kali của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 127,65 g kết tủa. Xác định tên 2 muối halogen. Tính % m 2 muối halogen.Câu 3: Cho 31,1 g hỗn hợp 2 halogen liên tiếp tác dụng vừa đủ với m gam Ba, thu được 65,35 g muối. Xác định tên 2 halogen. Tí...
Đọc tiếp
Câu 1: Cho 42,6 g muối natri của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 85,1 g hỗn hợp muối kết tủa. Xác định tên 2 muối halogen. Tính % khối lượng 2 muối trong hỗn hợp ban đầu.
Câu 2: Cho 75,9 g muối kali của 2 halogen liên tiếp nhau tác dụng với dung dịch AgNO3 dư, thu được 127,65 g kết tủa. Xác định tên 2 muối halogen. Tính % m 2 muối halogen.
Câu 3: Cho 31,1 g hỗn hợp 2 halogen liên tiếp tác dụng vừa đủ với m gam Ba, thu được 65,35 g muối. Xác định tên 2 halogen. Tính %m 2 halogen
Câu 4: Cho 5,4 g Al phản ứng vừa đủ với 34,65 g hỗn hợp 2 halogen liên tiếp. Xác định tên 2 halogen? Tính %m 2 muối halogen
Cho m gam đơn chất halogen X2 tác dụng với Mg dư thu được 19g muối . Cũng m gam X2 cho tác dụng với Al dư thu được 17,8g muối . Tìm X
\(n_{X_2}=\dfrac{m}{2.M_X}\left(mol\right)\)
PTHH: Mg + X2 --> MgX2
\(\dfrac{m}{2.M_X}\)-->\(\dfrac{m}{2.M_X}\)
2Al + 3X2 --> 2AlX3
\(\dfrac{m}{2.M_X}\)->\(\dfrac{m}{3.M_X}\)
=> \(\left\{{}\begin{matrix}\dfrac{m}{2.M_X}\left(24+2.M_X\right)=19\\\dfrac{m}{3.M_X}\left(27+3.M_X\right)=17,8\end{matrix}\right.\)
=> MX = 35,5 (g/mol)
=> X là Cl
Đúng 3
Bình luận (0)
Cho 1,03 gam muối natri halogen (NaX) tác dụng hết với dung dịch AgNO3 dư thì thu được một kết tủa, kết tủa này sau phản ứng phân hủy hoàn toàn cho 1,08 gam Ag. X là :
A. brom
B. flo
C. clo
D. iot
Đáp án A
nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
![]() , MX =80 (Br)
, MX =80 (Br)
Đúng 0
Bình luận (0)
Cho 3,9 gam K tác dụng với halogen X thu được 5,8 gam muối. Xác định tên halogen X.
\(n_{K}=\dfrac{3,9}{39}=0,1(mol)\\ PTHH:2K+X_2\to 2KX\\ \Rightarrow n_{K}=n_{KX}=0,1(mol)\\ \Rightarrow M_{KX}=\dfrac{5,8}{0,1}=58(g/mol)\\ \Rightarrow M_{x}=58-39=19(g/mol)\)
Vậy X là Flo (F)
Đúng 0
Bình luận (0)
Bài 18. Cho 35,411 gam hỗn hợp A gồm muối natri của hai halogen ở hai chu kì liên tiếp trong BTH tác dụng với dung dịch AgNO3 dư thu được 68,306 gam kết tủa.
a. Tìm tên hai halogen. b. Tính khối lượng từng muối trong hỗn hợp A.
- Nếu một trong 2 muối là NaF => Muối còn lại là NaCl
\(n_{AgCl}=\dfrac{68,306}{143,5}=0,476\left(mol\right)\)
PTHH: NaCl + AgNO3 --> NaNO3 + AgCl
0,476<-----------------------0,476
=> mNaCl = 0,476.58,5 = 27,846(g)
=> mNaF = 35,411 - 27,846 = 7,565(g)
- Nếu trong A không có NaF
=> Gọi công thức của 2 muối là NaX
=> \(n_{NaX}=\dfrac{35,411}{23+M_X}\left(mol\right)\)
PTHH: NaX + AgNO3 --> NaNO3 + AgX
\(\dfrac{35,411}{23+M_X}\)----------------->\(\dfrac{35,411}{23+M_X}\)
=> \(\dfrac{35,411}{23+M_X}=\dfrac{68,306}{108+M_X}\)
=> \(M_X=68,5\)
=> 2 muối là NaCl, NaBr
Gọi số mol của NaCl, NaBr là a, b
=> 58,5a + 103b = 35,411
PTHH: NaCl + AgNO3 --> AgCl + NaNO3
a------------------>a
NaBr + AgNO3 --> AgBr + NaNO3
b------------------->b
=> 143,5a + 188b = 68,306
=> a = 0,1; b = 0,287
=> \(\left\{{}\begin{matrix}m_{NaCl}=0,1.58,5=5,85\left(g\right)\\m_{NaBr}=0,287.103=29,561\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Hỗn hợp X chứa đồng thời hai muối natri của hai halogen liên tiếp trong bảng tuần hoàn. Lấy một lượng X cho tác dụng vừa đủ với 100 ml dung dịch AgNO3 1M thì thu được 15 gam kết tủa. Công thức phân tử của hai muối trong X là: A. NaF và NaCl B. NaBr và NaI C. NaCl và NaI D. NaCl và NaBr
Đọc tiếp
Hỗn hợp X chứa đồng thời hai muối natri của hai halogen liên tiếp trong bảng tuần hoàn. Lấy một lượng X cho tác dụng vừa đủ với 100 ml dung dịch AgNO3 1M thì thu được 15 gam kết tủa. Công thức phân tử của hai muối trong X là:
A. NaF và NaCl
B. NaBr và NaI
C. NaCl và NaI
D. NaCl và NaBr
Đáp án D
Trường hợp 1: Hai halogen đều tạo được kết tủa với AgNO3
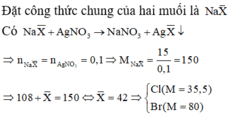
Do đó hai muối trong X là NaCl và NaBr
Trường hợp 2: Hai muối là NaF và NaCl
Phản ứng tạo thành kết tủa chỉ có AgCl và AgF là muối tan:
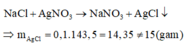
Do đó trường hợp này không thỏa mãn.
Đúng 0
Bình luận (0)
Cho 1.595 gam hỗn hợp hai muối natri halogen của hai nguyên tố halogen thuộc 2 chu kì liên tiếp nhau vào H2O được 500 gam dung dịch a cho dung dịch a tác dụng với dung dịch AgNO3 dư như thu được 2,87 gam kết tủa
a) tìm tên các halogen
b) tính phần trăm khối lượng mỗi
halogen
c) tuyến C% mỗi muối trong dung dịch a
Xem chi tiết
+) Trường hợp 1: Hỗn hợp gồm NaF và NaCl
PTHH: \(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Ta có: \(n_{AgCl}=\dfrac{2,87}{143,5}=0,02\left(mol\right)=n_{NaCl}\)
\(\Rightarrow m_{NaCl}=0,02\cdot58,5=1,17\left(g\right)\) \(\Rightarrow m_{NaF}=0,415\left(g\right)\)
+) Trường hợp 2: Hỗn hợp không chứa NaF
Gọi công thức chung 2 muối là NaR
PTHH: \(NaR+AgNO_3\rightarrow NaNO_3+AgR\downarrow\)
Theo PTHH: \(n_{NaR}=n_{AgR}\) \(\Rightarrow\dfrac{1,595}{23+\overline{M}_R}=\dfrac{2,87}{108+\overline{M}_R}\)
\(\Rightarrow\overline{M}_R\approx83,3\) \(\Rightarrow\) 2 halogen cần tìm là Brom và Iot
Vậy 2 muối có thể là (NaF và NaCl) hoặc (NaBr và NaI)
*P/s: Các phần còn lại bạn tự làm
Đúng 1
Bình luận (0)
Cho m gam đơn chất halogen X 2 tác dụng với Mg dư thu được 3,8g muối. Cũng m gam X 2 cho tác dụng với Al dư thu được 3,56g muối. X là
A. F.
B. Cl.
C. I.
D. Br.