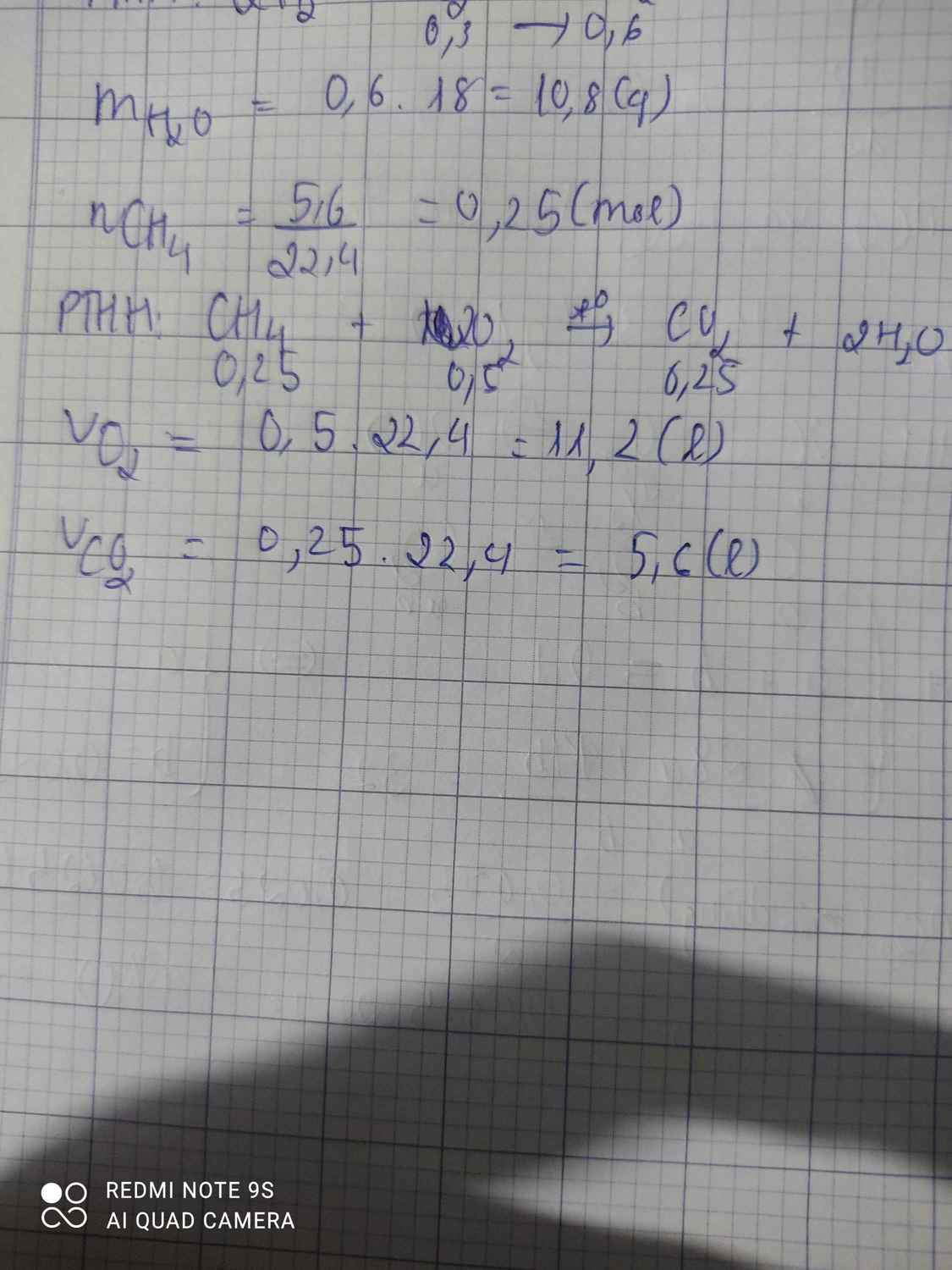Hãy tìm thể tích khí oxi(đktc) cần dùng để đốt cháy hoàn toàn 24 g cacbon

Những câu hỏi liên quan
Hãy tìm thể tích khí oxi ( ở đktc) cần dùng đốt cháy hoàn toàn 24 gam cacbon. ( cho biết : C=12, O=16) 💞
$C + O_2 \xrightarrow{t^o} CO_2$
Theo PTHH :
$n_{O_2} = n_C = \dfrac{24}{12} =2 (mol)$
$\Rightarrow V = 2.22,4 =4 4,8(lít)$
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 14,4 g cacbon trong bình đựng khí oxi .
a)Tính thể tích khí oxi cần dùng ( đktc) ?
b)Nếu đốt hoàn toàn lượng cacbon trên trong không khí thì thể tích không khí ( đktc) cần dùng
là bao nhiêu ?
c)Tính khối lượng KClO 3 bị nung nóng để thu được lượng oxi cần cho phản ứng trên, biết
trong quá trình thu khí có hao hụt 20% ?
\(n_C=\dfrac{14,4}{44}=\dfrac{18}{55}\left(mol\right)\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{O_2}=n_C=n_{CO_2}=\dfrac{18}{55}\left(mol\right)\\ a,V_{O_2\left(đktc\right)}=\dfrac{18}{55}.22,4=\dfrac{2016}{275}\left(lít\right)\\ b,V_{kk}=\dfrac{100}{21}.\dfrac{2016}{275}=\dfrac{381}{11}\left(lít\right)\\ c,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3\left(LT\right)}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.\dfrac{18}{55}=\dfrac{12}{55}\left(mol\right)\\ \Rightarrow n_{KClO_3\left(TT\right)}=120\%.\dfrac{12}{55}=\dfrac{72}{275}\left(mol\right)\\ \Rightarrow m_{KClO_3}=122,5.\dfrac{72}{275}=\dfrac{1764}{55}\left(g\right)\)
Đúng 3
Bình luận (0)
thể tích không khí tối thiểu (ở đktc, oxi chiếm 80% thể tích không khí) cần dùng để đốt cháy hoàn toàn 24 gam cacbon (tạo khí cacbonic) là bao nhiêu?
Đốt cháy hoàn toàn 5,6 lít khí metan hãy tính Thể tích khí oxi cần dùng và thể tích khí cacbon tạo thành biết các thể tích đó ở đktc ( biết C=12, H=1 S=32)
\(n_{CH_4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,25-->0,5-------->0,25
=> \(V_{O_2}=0,5.22,4=11,2\left(l\right)\)
\(V_{CO_2}=0,25.22,4=5,6\left(l\right)\)
Đúng 4
Bình luận (1)
Thể tích không khí cần dùng là bao nhiêu để đốt cháy hoàn toàn 18g cacbon.( Biết khí oxi chiếm \(\dfrac{1}{5}\) thể tích không khí). Tính thể tích CO2 tạo thành( ở đktc)
C+O2-to>CO2
1,5--1,5 -----1,5mol
n C=\(\dfrac{18}{12}\)=1,5 mol
=>Vkk=1,5.22,4.5=168l
=>VCO2=1,5.22,4=33,6l
Đúng 2
Bình luận (0)
nC = 18/12 = 1,5 (mol)
PTHH: C + O2 -> (t°) CO2
Mol: 1,5 ---> 1,5 ---> 1,5
VO2 = 1,5 . 22,4 = 33,6 (l)
Vkk = 33,6 . 5 = 168 (l)
VCO2 = 1,5 . 22,4 = 33,6 (l)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 4,8g cacbon trong không khí (biết oxi chiếm 1/5 thể tích không khí). Thể tích không khí cần dùng (đktc) là:
C (0,4 mol) + O2 (0,4 mol) \(\underrightarrow{t^o}\) CO2.
Thể tích không khí cần dùng (đktc) là V=0,4.5.22,4=44,8 (lít).
Đúng 1
Bình luận (2)
nC = 4,8 : 12=0 ,4 (mol)
pthh : C+ O2 --> CO2
0,4-->0,4 (mol)
=> VO2 = 0,4 . 22,4 = 8,96 (L)
ta co : VO2 = 1/5 Vkk => VKK = VO2 : 1/5 = 8,96 : 1/5 = 44,8 (l)
Đúng 1
Bình luận (0)
Câu 8. Đốt cháy hoàn toàn 6 gam cacbon trong khí oxi dư, thu được khí cacbon đioxit.
a.Viết phương trình hóa học.
b.Tính khối lượng cacbon đioxit thu được.
c.Tính thể tích khí oxi (đktc)tối thiểu cần dùng để tác dụng vừa đủ với lượng cacbon trên.
d.Tính thể tích không khí (đktc) tối thiểu cần dùng để tác dụng vừa đủ với lượng cacbon trên.
a) C + O2 --to--> CO2
b) \(n_C=\dfrac{6}{12}=0,5\left(mol\right)\)
PTHH: C + O2 --to--> CO2
0,5-->0,5------->0,5
=> mCO2 = 0,5.44 = 22 (g)
c) VO2 = 0,5.22,4 = 11,2 (l)
d) Vkk = 11,2.5 = 56 (l)
Đúng 4
Bình luận (0)
Để đốt cháy hoàn toàn 2,4g cacbon thành khí cacbon đioxit CO2 cần bao nhiêu lít không khí (đktc ) ? Biết thể tích khí oxi chiếm 1/5 thể tích không khí
Xem chi tiết
nC = 2.4/12 = 0.2 mol
C + O2 -to-> CO2
0.2__0.2
VKK = 5VO2 = 5*0.2*22.4 = 22.4 (l)
Đúng 0
Bình luận (0)
đốt cháy hoàn toàn 1,12dm3(đktc)khí axeliten C2H2 trong ko khí
a/tính thể tích khí cacbon dioxit thu được (ở đktc)
b/tính thể tích không khí cần dùng (đktc) biết Oxi chiếm 1/5 thể tích không khí
\(n_{C_2H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(C_2H_2+\dfrac{5}{2}O_2\underrightarrow{^{^{t^0}}}2CO_2+H_2O\)
\(0.05.......0.125........0.1\)
\(V_{CO_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(V_{kk}=5\cdot V_{O_2}=5\cdot0.125\cdot22.4=14\left(l\right)\)
Đúng 1
Bình luận (0)