giúp em với ạ!![]()
Khi hòa tan một chất khí vào nước ta cần.
A.Tăng nhiệt độ, tăng áp suất.
B.Tăng nhiệt độ, giảm áp suất.
C.Giảm nhiệt độ, tăng áp suất.
D.Giảm nhiệt độ, giảm áp suất
Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trog nước A. Đều giảm B. Đều tăng C. Cs thể tăng hoặc giảm D. Ko tăng cũng ko giảm
Muốn cho cân bằng của phản ứng tổng hợp amoniac sang phải, cần phải đồng thời:
A. Tăng áp suất và tăng nhiệt độ.
B. Giảm áp suất và giảm nhiệt độ.
C. Tăng áp suất và giảm nhiệt độ.
D. Giảm áp suất và tăng nhiệt độ.
- Đáp án C.
- Phản ứng điều chế NH3:
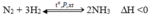
- Sau phản ứng số mol khí giảm nên theo nguyên lí chuyển dịch cân bằng khi tăng áp suất cân bằng chuyển dịch theo chiều giảm áp suất (chiều thuận).
- Phản ứng này toả nhiệt nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt độ (chiều thuận)
Một bình chứa 1 lượng khí ở nhiệt độ 30ºC và áp suất là 2.10^5 pa. Biết thể tích khí không đổi a) Hỏi phải tăng nhiệt độ lên đến bao nhiêu độ ( K ) để áp suất tăng gấp đôi b) Hỏi nếu giảm nhiệt độ xuống bao nhiêu độ C để áp suất giảm còn một nữa giúp với ạ :>
\(a,\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{T_1p_2}{p_1}=\dfrac{303.4.10^5}{2.10^5}=606^oK\\ b,T_2=\dfrac{303.10^5}{2.10^5}=151,5^oK\)
Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước:
A. đều tăng.
B. đều giảm.
C. có thể tăng và có thể giảm.
D. không tăng và cũng không giảm.
Muốn cho cân bằng của phản ứng tổng hợp amoniac chuyển dịch sang phải, cần phải đồng thời
A. tăng áp suất và tăng nhiệt độ.
B. giảm áp suất và giảm nhiệt độ.
C. tăng áp suất và giảm nhiệt độ.
D. giảm áp suất và tăng nhiệt độ
Đáp án B
Phản ứng thuận của phản ứng tổng hợp amoniac là phản ứng tỏa nhiệt. Vì vậy muốn cân bằng chuyển dịch sang phải thì ta đồng thời phải giảm nhiệt độ và tăng áp suất.
1. Cho phương trình hóa học tổng hợp NH3: N2(k) + 3H2(k) D2NH3 (k) ; ![]() H = -92kJ
H = -92kJ
Hiệu suất phản ứng tổng hợp NH3 tăng nếu
A. Giảm áp suất, tăng nhiệt độ có xúc tác. B. Giảm áp suất, giảm nhiệt độ có xúc tác
C. Tăng áp suất, giảm nhiệt độ có xúc tác D. Tăng áp suất, tăng nhiệt độ có xúc tác
Đáp án C
- Dùng xúc tác có tác dụng tăng tốc độ phản ứng
- Phản ứng có ΔH < 0 ⇒ Phản ứng thuận tỏa nhiệt. Nên để tăng hiệu suất cần giảm nhiệt độ phản ứng, tuy nhiên nếu ở nhiệt độ quá thấp, các phân tử khí không có đủ năng lượng để xảy ra va chạm và tạo ra sản phẩm nên nhiệt độ thích hợp của phản ứng là 400 - 500 độ C
- Phản ứng có tổng hệ số chất khí bên phải nhỏ hơn bên trái nên khi tăng áp suất , cân bằng phản ứng chuyển dịch theo chiều thuận làm tăng hiệu suất vì vậy phản ứng được thực hiện ở áp suất cao (100 - 150 atm)
Người ta biến đổi trạng thái một lượng khí lý tưởng không đổi sao cho áp suất khí tăng thêm một lượng bằng 20% áp suất bạn đầu, thể tích khí giảm 1,5 lần thì nhiệt độ khí giảm đi 800C. Nhiệt độ ban đầu của khí bằng?
Câu 11 : Khi tăng nhiệt độ và áp suất thì độ tan của chất khí trong nước là .
A. Đều tăng
B. Đều giảm
C. Phần lớn tăng
D. Phần lớn là giảm
E. Không tăng và cũng không giảm
Một lượng khí xác định có áp suất 10⁵ Pa nhiệt độ 27°C sau khi bị nén thể tích khí giảm đi 3 lần áp suất tăng lên đến 5.10⁵Pa .Tính nhiệt độ cuối quá trình nén
\(T_1=27^oC=300K\)
\(V_2=\dfrac{1}{3}V_1\)
Phương trình trạng thái khí lí tưởng:
\(\dfrac{p_1.V_1}{T_1}=\dfrac{p_2.V_2}{T_2}\)
\(\Leftrightarrow\dfrac{10^5.V_1}{300}=\dfrac{5.10^5.\dfrac{1}{3}V_1}{T_2}\)
\(\Leftrightarrow T_2=500K\)