Cho kim loại Mg vào 200ml dung dịch HCl 1M. Sau phản ứng thu đc bao nhiêu gam muối

Những câu hỏi liên quan
Cho 3,84 gam hỗn hợp Mg và Al tác dụng với 200ml dung dịch HCl 1,45M
a, Chứng minh hỗn hợp kim loại còn dư
b, Nếu sau phản ứng thu được 13,325 gam muối khan thì khối lượng mỗi kimloaji trong hỗn hợp đầu là bao nhiêu gam ?
c, Dung dịch sau phản ứng có thể tác dụng tối đa V lít dung dịch kiềm NaOH 0,7M và Ba(OH)2 0,5M. Tính V
Cho 3,84 gam hỗn hợp Mg và Al tác dụng với 200ml dung dịch HCl 1,45M
a, Chứng minh hỗn hợp kim loại còn dư
b, Nếu sau phản ứng thu được 13,325 gam muối khan thì khối lượng mỗi kimloaji trong hỗn hợp đầu là bao nhiêu gam ?
c, Dung dịch sau phản ứng có thể tác dụng tối đa V lít dung dịch kiềm NaOH 0,7M và Ba(OH)2 0,5M. Tính V
Hoà tan 12 g hỗn hợp Fe, Mg vào 200ml dung dịch hỗn hợp H2SO4 1M và HCl 1M, phản ứng xảy ra vừa đủ.
a. Tính thể tích khí H2 (đktc)
b. Cô cạn dung dịch thu được bao nhiêu gam muối ?
Cho 6,5 gam kim loại Zn tác dụng với 500ml dung dịch HCl 1M. Sau phản ứng thu được muối ZnCl2 và khí Hydrogen. Sau phản ứng chất nào còn dư? Dư bao nhiêu?
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right);n_{HCl}=0,5.1=0,5\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,5}{2}>\dfrac{0,1}{1}\Rightarrow Zn.hết,HCldư\\ n_{HCl\left(dư\right)}=0,5-2.0,1=0,3\left(mol\right)\\ m_{HCl\left(dư\right)}=0,3.36,5=10,95\left(g\right)\)
Đúng 1
Bình luận (0)
Cho m gam hỗn hợp gồm (Al, Mg, Cu) phản ứng với 200ml dung dịch HNO3 1M. Sau phản ứng thu được (m + 6,2) gam muối khan gồm 3 muối. Nung muối này tới khối lượng không đổi. Hỏi khối lượng chất rắn thu được bằng bao nhiêu? A. m gam B. (m+1,6) gam C. (m+3,2) gam D. (m+0,8) gam
Đọc tiếp
Cho m gam hỗn hợp gồm (Al, Mg, Cu) phản ứng với 200ml dung dịch HNO3 1M. Sau phản ứng thu được (m + 6,2) gam muối khan gồm 3 muối. Nung muối này tới khối lượng không đổi. Hỏi khối lượng chất rắn thu được bằng bao nhiêu?
A. m gam
B. (m+1,6) gam
C. (m+3,2) gam
D. (m+0,8) gam
Cho 9,6 gam bột kim loại M vào 500ml dung dịch HCl 1M, sau phản ứng kết thúc thu được 5,376 (lít) H2 (đktc). Kim loại M là kim loại nào sau đây.
A. Mg.
B. Cu.
C. Fe.
D. Cr.
Đáp án B.
Số mol H2 là:
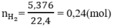
Số mol HCl nHCl = 0,5.1 = 0,5(mol)
2M + 2nHCl → 2MCln + nH2
Số mol HCl phản ứng: nHCl = 2. nH2 = 2.0,24 = 0,48(mol). So với ban đầu HCl phản ứng còn dư
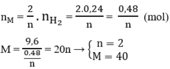
Vậy M là Ca
Đúng 0
Bình luận (0)
Cho 8,00 gam hỗn hợp x gồm Mg và Fe tác dụng vừa đủ với dung dịch HCl 1M sau phản ứng thu được 22,20 gam hỗn hợp muối a.tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X b.Tính thể tích dung dịch HCl đã dùng
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 24x + 56y = 8 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=x\left(mol\right)\\n_{FeCl_2}=n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 95x + 127y = 22,2 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{8}.100\%=30\%\\\%m_{Fe}=70\%\end{matrix}\right.\)
b, \(n_{HCl}=2n_{Mg}+2n_{Fe}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,4}{1}=0,4\left(l\right)\)
Đúng 1
Bình luận (2)
cho 4,6 gam hỗn hợp x gồm 2 kim loại kiềm vào 200ml dung dịch hcl 1m sau phản ứng thu được Y chỉ chứa 2 muối có nồng độ mol bằng nhau. Xác định 2 kim loại kiềm.
Vì 2 muối có số mol bằng nhau \(\rightarrow\) 2 kim loại có số mol bằng nhau
\(X+HCl\rightarrow XCl+\frac{1}{2}H_2\)
Ta có: \(n_{HCl}=0,2.1=0,2\left(mol\right)=n_X\)
\(\rightarrow M_X=\frac{4,6}{0,2}=23\)
Vì số mol bằng nhau \(\rightarrow\) trung bình cộng của 2 kim loại kiềm là 23
\(\Rightarrow\) Kim loại kiềm có khối lượng phân tử bé < 23 \(\Rightarrow\) Li (7)
\(\Rightarrow\) Kim loại còn lại là K (39)
\(\frac{39+7}{2}=23\left(+\right)\)
Cho 4,8 gam kim loại Mg vào 200ml dung dịch HCl 1,5M
a)Viết PTHH,Tính thể tích khí thoát ra ở đktc
b)Tính nồng độ mol của chất có trong dung dịch thu được sau phản ứng(giả sử quá trình phản ứng không làm thay đổi thể tích dung dịch)
\(a.n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ n_{HCl}=0,2.1,5=0,3\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ Vì:\dfrac{0,3}{2}< \dfrac{0,2}{1}\\ \Rightarrow Mgdư\\ n_{H_2}=n_{MgCl_2}=\dfrac{0,3}{2}=0,15\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\\ b.V_{ddsau}=V_{ddHCl}=0,2\left(l\right)\\ C_{MddMgCl_2}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
Đúng 2
Bình luận (0)

















