Cho hợp chất oxit của sắt FexOy; Hóa trị của Fe trong công thức hóa học trên là

Những câu hỏi liên quan
Hòa tan 3,2g một oxit sắt FexOy nguyên chất cần 4,38g HCl. Xác định CTHH của oxit sắt
Coi oxit sắt gồm hai nguyên tố Fe,O
Bản chất là O trong oxit tác dụng với H trong axit để tạo nước.
\(2H + O \to H_2O\)
\(n_H = n_{HCl} = \dfrac{4,38}{36,5} = 0,12(mol)\)
Theo PTHH :
\(n_O = \dfrac{1}{2}n_H = 0,06(mol)\)
\(\Rightarrow n_{Fe} = \dfrac{3,2-0,06.16}{56} = 0,04(mol)\)
Ta có :
\(\dfrac{n_{Fe}}{n_O} = \dfrac{0,04}{0,06} = \dfrac{2}{3}\)
Vậy oxit sắt cần tìm : \(Fe_2O_3\)
Đúng 1
Bình luận (0)
Dẫn 8.96l hidro(dktc) qua m gam oxit sắt FexOy nung nóng. Sau phản ứng thu được 7,2g nước và hỗn hợp A gồm 2 chất rắn nặng 28,4g. Biết p.ư xảy ra hoàn toàn.
a/ tìm m
b/ lập cthh của oxit sắt, biết A chứa 59.155% k.lg sắt đơn chất
1)yH2 + FexOy --> xFe + yH2On
H2 = 8,96/22,4 = 0,4 (mol)
nH2O = 7,2/18 = 0,4 (mol)
=> H2 đã phản ứng hết hay FexOy dư
mH2 = 2.0,4 = 0,8 (g)
Ta có m = mA + mH2O - mH2 = 28,4 + 7,2 - 0,8 = 34,8 (g)
2)Trong A chứa 59,155% Fe=
> mFe = 59,155%.28,4 = 16,8 (g)
=> nFe = 16,8/56 = 0,3 mol
Từ pt pư ta cóx/y = nFe/nH2 = 0,3/0,4 = 3/4=> Oxit sắt đã dùng là Fe3O4
Đúng 0
Bình luận (5)
cho 32g oxit sắt từ (FexOy) tác dụng với h2 dư thu được 22,4 gam sắt,tìm công thức của oxit sắt từ (FexOy)
\(n_{Fe_xO_y}=\dfrac{32}{56x+16y}\left(mol\right)\)
PTHH: FexOy + yH2 --to--> xFe + yH2O
\(\dfrac{32}{56x+16y}\)----------->\(\dfrac{32x}{56x+16y}\)
=> \(\dfrac{32x}{56x+16y}=\dfrac{22,4}{56}=0,4\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTHH: Fe2O3
Đúng 3
Bình luận (0)
\(n_{Fe}=\dfrac{22,4}{56}=0,4mol\)
\(Fe_xO_y+yH_2\rightarrow xFe+yH_2O\)
\(\dfrac{0,4}{x}\) 0,4
\(\Rightarrow M=\dfrac{32}{\dfrac{0,4}{x}}=80x\)
Mà \(M_{Fe_xO_y}=56x+16y=80x\Rightarrow16y=24x\Rightarrow\dfrac{x}{y}=\dfrac{16}{24}=\dfrac{2}{3}\)
\(\Rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\Rightarrow Fe_2O_3\)
Đúng 4
Bình luận (1)
Dẫn từ từ 8,96 lít H2 (đktc) qua m gam oxit sắt FexOy nung nóng. Sau phản ứng thu được 7,2 gam nước và hỗn hợp A gồm 2 chất rắn nặng 28,4 gam (phản ứng xảy ra hoàn toàn) :
a/ Tính giá trị của m?
b/ Lập công thức phân tử của oxit sắt, biết A chứa 59,155% khối lượng sắt đơn chất.
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(BTKL:\)
\(m+0.4\cdot2=28.4+7.2\)
\(\Rightarrow m=34.8\left(g\right)\)
\(b.\)
\(m_{Fe}=0.59155\cdot28.4=16.8\left(g\right)\)
\(n_{Fe}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
\(PTHH:\)
\(\dfrac{x}{y}=\dfrac{n_{Fe}}{n_{H_2}}=\dfrac{0.3}{0.4}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)
Đúng 3
Bình luận (0)
Cho C đi qua hỗn hợp FexOy và CuO có tỉ lệ mol 1:2 đến khi các oxit bị khử hết thì thu được 3 gam chất rắn và 0,7 lit khí CO2 ( đktc). Xác định công thức của oxit sắt.
Gọi số mol của FexOy là a, suy ra CuO là 2a.
\(2Fe_xO_y+yC\rightarrow2xFe+yCO_2\)
\(2CuO+C\rightarrow2Cu+CO_2\)
\(\Rightarrow n_{Fe}=xn_{FexOy}=ax,n_{Cu}=n_{CuO}=2a\)
\(\Rightarrow56.ax+64.2a=3\)
\(\Rightarrow n_{CO2}=0,5yn_{FexOy}+\frac{1}{2}n_{CuO}=0,5ay+a=\frac{0,7}{22,4}=0,03125\)
\(\Rightarrow\frac{a\left(56+128\right)}{a\left(0,5y+1\right)}=\frac{3}{0,03125}=96\)
\(56x+128=48y+96\Rightarrow56x+32=48y\)
\(\Rightarrow6y-7x=4\)
Chỉ thỏa mãn cặp nghiệm x=2; y=3.
Vậy oxit là Fe2O3
Đúng 0
Bình luận (0)
Nung nóng 2,4 g hỗn hợp CuO và một oxit sắt (FexOy), rồi cho luồng khí H2 đi qua cho
đến khi khử hết các oxit thì thu được 1,76 g chất rắn. Nếu hoà tan chất rắn đó bằng dung dịch
HCl dư thì thấy có 0,448 lít khí H2 (đktc) thoát ra. Xác định công thức của oxit sắt đó? Cho biết số mol của 2 oxit trong hỗn hợp bằng nhau
nH2= 0,448/22,4= 0,02(mol)
PTHH :
CuO + H2 -tdo--> Cu + H20
FexOy + yH2 -tdo-> xFe + yH20
Cu + HCl --> k pu
Fe + 2HCl ---> FeCl2 + H2
0,02 -- 0,04---> 0,02 --- 0,02 (mol)
mFe = 0,02 .56= 1,12(g)
=> mCu = 1,76 - 1,12= 0,64(g)
n Cu = 0,64 /64 =0,01(mol)
PTHH :
CuO + H2 -tdo-> Cu + H20
0,,01 --0,01 ----> 0,01(mol)
mCuO= 0,01 . 80 = 0,8(g)
=> mFexOy = 2,4-0,8= 1,6(g)
PTHH :
FexOy + yH2 ---> xFe + yH20
56x+ 16y ---------> 56x
1,6 (g) -------------> 1,12(g)
<=> 1,6 .56x = 1,12( 56x + 16y)
<=> 89,6x = 62,72 x + 17,92y
<=> 89,6x - 62,72x = 17,92y
<=> 26,88 x = 17,92y
=> x/y= 17,92 / 26,88 =2/3
Vậy công thức đúng là Fe203.
Đúng 0
Bình luận (0)
Dẫn từ từ 8,96 lít H2 (đktc) qua m gam oxit sắt FexOy nung nóng. Sau phản ứng thu được 7,2 gam nước và hỗn hợp A gồm 2 chất rắn nặng 28,4 gam (phản ứng xảy ra hoàn toàn) :
a/ Tính giá trị của m?
b/ Lập công thức phân tử của oxit sắt, biết A chứa 59,155% khối lượng sắt đơn chất.
Xem chi tiết
a/ Tính giá trị của m?
b/ Lập công thức phân tử của oxit sắt, biết A chứa 59,155% khối lượng sắt đơn chất.
a)
nH2 = 8.96/22.4 = 0.4 (mol) => mH2 = 0.4x2 = 0.8 (g)
yH2 + FexOy --to--> xFe + yH2O
theo đlbtkl ta có:
mH2 + mFexOybanđầu = mFe + mFexOydư + mH2O
<=> 0.8 + m = 28.4 + 7.2
=> m = 34.8 (g)
b)
mFe = 28,4x59,155% = 16.8 (g) => nFe = 16.8/56 = 0.3 (mol)
yH2 + FexOy --to--> xFe + yH2O
0.4______________0.3
=> x : y = 0.3 : 0.4 = 3 : 4 => Fe3O4
Đúng 0
Bình luận (0)
a) \(n_{H_2\left(đầu\right)}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
\(n_{H_2O}=\dfrac{2,4.10^{23}}{6.10^{23}}=0,4\left(mol\right)\)
Bảo toàn H2:
\(n_{H_2phảnứng}=n_{H_2O}=0,4mol\)
Áp dụng định luật bảo toàn khối lượng ta có:
m = 0,4.18 + 28,4 - 0,4.2 = 34,8 (g)
b) yH2 + FexOy \(\underrightarrow{t^o}\) xFe + yH2O
\(m_{Fe_xO_y\left(X\right)}=28,4.\left(100\%-59,155\%\right)=11,6\left(g\right)\)
\(m_{Fe_xO_yphảnứng}=31,8-11,6=23,2\left(g\right)\)
\(n_{Fe\left(X\right)}=n_{Fe\left(Fe_xO_yphảnứng\right)}=\dfrac{28,4.59,155\%}{56}=0,3\left(mol\right)\)
\(n_O=n_{H_2O}=0,4mol\)
x : y = 0,3 : 0,4 = 3 : 4
⇒ CT: Fe3O4
Đúng 0
Bình luận (0)
Nung nóng 18,56 gam hỗn hợp A gồm FeCO3 và một oixt sắt FexOy trong không khí tới khi phản ứng xảy ra hoàn toàn, thu được khí CO2 và 16 gam một oxit sắt duy nhất. Cho khí CO2 hấp thụ hết vào dung dịch Ba(OH)2 dư thu được 15,76 gam kết tủa. Vậy công thức oxit FexOy là: A. FeO B. Fe3O4 C. Fe2O3 D. Fe2O3 hoặc FeO
Đọc tiếp
Nung nóng 18,56 gam hỗn hợp A gồm FeCO3 và một oixt sắt FexOy trong không khí tới khi phản ứng xảy ra hoàn toàn, thu được khí CO2 và 16 gam một oxit sắt duy nhất. Cho khí CO2 hấp thụ hết vào dung dịch Ba(OH)2 dư thu được 15,76 gam kết tủa. Vậy công thức oxit FexOy là:
A. FeO
B. Fe3O4
C. Fe2O3
D. Fe2O3 hoặc FeO
Các oxit sắt, nung ngoài không khí đến khối lượng không đổi luôn tạo thành Fe2O3 16 gam oxit sắt duy nhất là Fe2O3.
Cách 1: Phương pháp đại số
Đặt số mol các chất trong 18,56 gam A F e C O 3 : n ; F e x O y : m
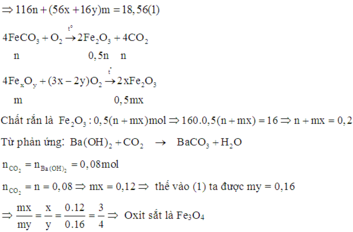
Cách 2: Phương pháp bảo toàn
Đặt số mol các chất trong 18,56 gam A F e C O 3 : n ; F e x O y : m
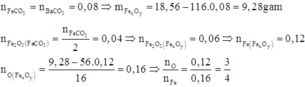
Cách 3: Bảo toàn nguyên tử C và O:
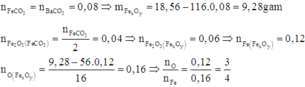
⇒ Oxit của sắt là Fe3O4
Cách 4: Bảo toàn nguyên tử và khối lượng:
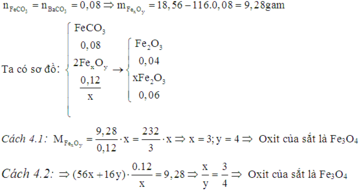
Đáp án B.
Đúng 0
Bình luận (0)
hòa tan hỗn hợp Mg và MgCO3 vào 200 ml dung dịch HCl 20%(d =0,5475 g/ml) thu được dung dịch A và 5,6l khí B(dktc). Tỉ khối của khí Bso với khí hiđro là 9,4.
â,Tính thành phần % theo khối lượng các chất trong hỗn hợp ban đầu? Tính nồng độ %các chất trong dung dịch A?
b,Hỗn hợp khí B tác dụng vừa đủ với 8g oxit sắt FexOy cho ra sắt kim loại . Xác định CT của oxit sắt



























