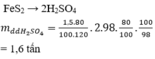tính khối lượng quặng sắt có trong 3 tấn quặng chứa 90% FeS2

Những câu hỏi liên quan
Một loại quặng sắt manhetit chứa 90% F e 3 O 4 . Tính khối lượng của Fe có trong 1 tấn quặng trên.
Đổi 1 tấn = 1000 kg
nFe2O3 = 1000 . 90% : 160 = 5,625 (kmol)
nFe = 5,625 . 3 = 16,875 (kmol)
mFe = 16,875 . 945 (kg)
Đúng 1
Bình luận (0)
1 loại quặng sắt chứa 90% Fe3O4 .Tính khối lượng sắt có trong 1 tấn quặng đó
trong công nghiệp người ta điều chế H2SO4 từ quặng pirit sắt có thành phần chính là FeS2 theo sơ đồ sau FeS2->SO2->SO3->H2SO4.tính khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2 .Biết hiệu của cả quá trình là 80%
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)
Đúng 1
Bình luận (2)
\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
Đúng 1
Bình luận (0)
tính khối lượng quặng pirit sắt chứa 90% FeS2 còn lại là tạp chất trơ cần dùng để sản xuất 5000 tấn Fe . giả sử hiệu suất phản ứng đạt 89,6%
\(n_{Fe} = \dfrac{5000.1000}{56} = \dfrac{625000}{7}\ kmol\\ n_{FeS_2\ đã\ dùng} = \dfrac{n_{Fe}}{H\%} = \dfrac{\dfrac{625000}{7}}{89,6\%} = 99649,23\ kmol\\ m_{quăng\ pirit} = \dfrac{m_{FeS_2}}{90\%} = \dfrac{99649,23.120}{90\%} = 13259897,33 (kg) = 13259,89(tấn)\)
Đúng 1
Bình luận (0)
\(n_{Fe}=\dfrac{5000\cdot10^6}{56}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(BTFe:\)
\(n_{FeS_2}=n_{Fe}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(n_{FeS_2\left(tt\right)}=\dfrac{\dfrac{625}{7}\cdot10^6}{89.6}=\dfrac{56000\cdot10^6}{7}\left(mol\right)\)
\(\Rightarrow m_{FeS_2}=\dfrac{56000\cdot10^6\cdot120}{7}=960000\cdot10^6\left(g\right)=960000\left(tấn\right)\)
\(m_{quặng}=\dfrac{960000\cdot100}{90}=1066666.67\left(tấn\right)\)
Đúng 0
Bình luận (0)
Bài 3: Một loại quặng chứa 90% oxit Fe 2 O 3 (10% là tạp chất không phải
sắt) Hãy tính:
a) Khối lượng sắt trong 1 tấn quặng.
b) Khối lượng quặng cần để lấy 1 tấn sắt.
a)
$m_{Fe_2O_3} = 1000.90\% = 900(kg)$
$n_{Fe_2O_3} = \dfrac{900}{160} = 5,625(kmol)$
$n_{Fe} = 2n_{Fe_2O_3} = 11,25(kmol)$
$m_{Fe} = 11,25.56 = 630(kg)$
b)
$n_{Fe} = \dfrac{1000}{56}(kmol)$
$n_{Fe_2O_3} = 0,5n_{Fe} = \dfrac{125}{14}(kmol)$
$m_{Fe_2O_3} = \dfrac{125}{14}.160 = \dfrac{10000}{7}(kg)$
$m_{quặng} = \dfrac{10000}{7} : 90\% = 1587,3(kg)$
Đúng 0
Bình luận (0)
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch
H
2
S
O
4
98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80%
F
e
S
2
(hiệu suất toàn quá trình là 80%) là A. 0,80 tấn B. 1,60 tấn C. 1,25 tấn D. 2,00 tấn
Đọc tiếp
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch H 2 S O 4 98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% F e S 2 (hiệu suất toàn quá trình là 80%) là
A. 0,80 tấn
B. 1,60 tấn
C. 1,25 tấn
D. 2,00 tấn
Có 2 quặng sắt: quặng 1 chứa 70% sắt, quặng 2 chứa 40% sắt. Người ta trộn một lượng quặng loại 1 với một lượng quặng loại 2 thì được hỗn hợp quặng chứa 60% sắt. Nếu lấy giảm đi 8 tấn quặng loại 1 và giảm đi 2 tấn khối lượng loại 2 thì được hỗn hợp quặng chứa 58% sắt. Tính khối lượng mỗi loại quặng đem trộn lúc đầu
Gọi khối lượng mỗi quặng là a và b (tấn)
ta có: \(\frac{70a+40b}{a+b}=60\Leftrightarrow\frac{30a}{a+b}+40=60\Leftrightarrow30a=20\left(a+b\right)\Leftrightarrow10a=20b\Leftrightarrow a=2b\)
lại có\(\frac{70\left(a-8\right)+40\left(b-2\right)}{\left(a-8\right)+\left(b-2\right)}=58\Leftrightarrow\frac{30\left(a-8\right)}{a-8+b-2}+40=58\Leftrightarrow30\left(a-8\right)=18\left(a+b-10\right)\)
\(\Leftrightarrow30a-240=18a+18b-180\Leftrightarrow12a-18b=60\)
thay a=2b vào phương trình trên ta có
\(12\times2b-18b=60\Leftrightarrow24b-18b=60\Leftrightarrow6b=60\Leftrightarrow b=10\Rightarrow a=20\)
Vậy khối lượng quặng 1 là 20 tấn, khối lượng quặng 2 là 10 tấn
Đúng 0
Bình luận (0)
Có 2 loại quặng chứa 75% sắt và 50% sắt. Tính khối lượng quặng chứa 75% sắt đem trộn với quặng chứa 50% sắt để được 35 tấn quặng chứa 66% sắt.
A. 16 tấn
B. 9 tấn
C. 10 tấn
D. 8 tấn
Gọi khối lượng quặng chứa 75% sắt đem trộn là x tấn,
Gọi khối lượng quặng chứa 50% sắt đem trộn là y tấn (x, y > 0)
Theo đề bài ta có hệ phương trình:
x + y = 25 75 % x + 50 % y = 66 % .25 ⇔ x + y = 25 0 , 75 x + 0 , 5 y = 16 , 5 ⇔ 0 , 5 x + 0 , 5 y = 12 , 5 0 , 75 x + 0 , 5 y = 16 , 5 ⇔ 0 , 25 x = 4 x + y = 25 ⇔ x = 16 y = 9 ( t m d k )
Vậy khối lượng quặng chứa 75% sắt đem trộn là 16 tấn
Đáp án:A
Đúng 0
Bình luận (0)
Một loại quặng sắt chứa 90% Fe3O4.
a,Tính khối lượng của Fe có trong 1 tấn quặng trên.
b,Khối lượng quặng cần để lấy được 1 tấn sắt trên
a) Khối lượng Fe3O4 trong 1 tấn quặng sắt là:
mFe3O4 = 1.90% = 0,9 (tấn)
Phần trăm khối lượng Fe trong hợp chất Fe3O4 là:
%mFe = \(\dfrac{3.56}{3.56+4.16}\).100%= \(\dfrac{2100}{29}\)%
Khối lượng Fe có trong một tấn quặng là:
mFe = 0,9.\(\dfrac{2100}{29}\)% = 0,652 (tấn)
Đúng 0
Bình luận (0)