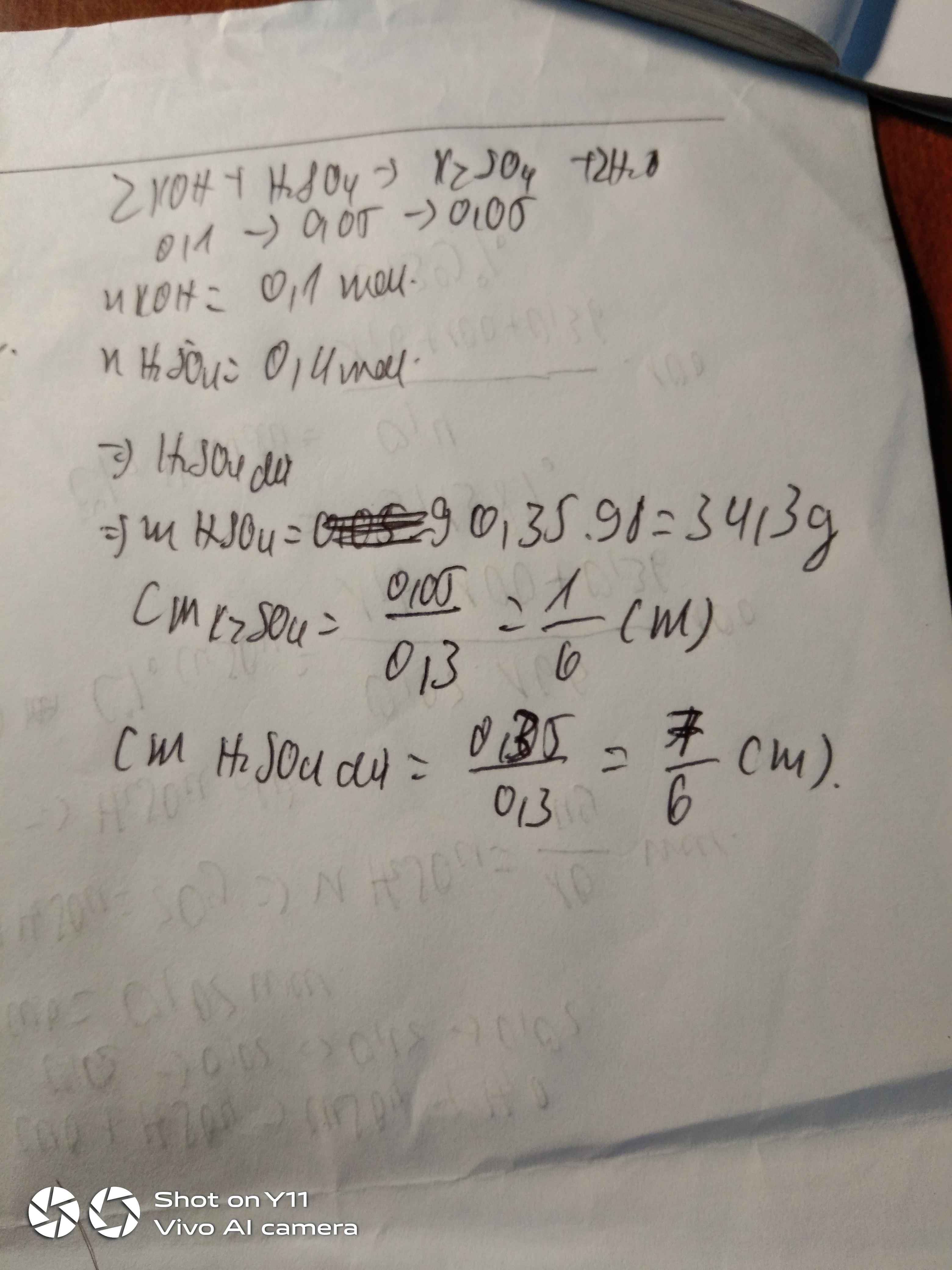cho 200ml dd KOH 0,2M tác dụng với 150ml dd H3PO4 0,15M .Tính nồng độ mol các chất sau phản ứng

Những câu hỏi liên quan
Cho 200ml dung dịch KOH 0,2M tác dụng với 150ml dung dịch H3PO4 0,15M.Tính nồng độ mol các chất sau phản ứng
nKOH = 0,2.0,2 = 0,04 (mol)
nH3PO4 = 0,15.0,15 = 0,0225 (mol)
Xét \(\dfrac{n_{KOH}}{n_{H_3PO_4}}=\dfrac{0,04}{0,0225}=1,778\)
=> Tạo ra muối H2PO4- và HPO42-
PTHH: KOH + H3PO4 --> KH2PO4 + H2O
______a---------a-----------------a
2KOH + H3PO4 --> K2HPO4 + 2H2O
_2b----------b--------------b
=> \(\left\{{}\begin{matrix}a+b=0,0225\\a+2b=0,04\end{matrix}\right.=>\left\{{}\begin{matrix}a=0,005\\b=0,0175\end{matrix}\right.\)
\(\left\{{}\begin{matrix}C_{M\left(KH_2PO_4\right)}=\dfrac{0,005}{0,2+0,15}=0,0143M\\C_{M\left(K_2HPO_4\right)}=\dfrac{0,0175}{0,2+0,15}=0,05M\end{matrix}\right.\)
Đúng 1
Bình luận (0)
cho 100ml dd KOH 1M phản ứng với 200ml dd H2SO4 nồng độ 2M a) hỏi sau phản ứng chất nào dư, dư bao nhiêu b) tính nồng độ mol của dd sau phản ứng
Cho 150ml dd H3PO4 tác dụng với 200ml dd NaOH 1M . Xác định muối tạo thành sau phản ứng ? Tính khối lượng muối ?
Cho 150ml dd KOH 2M phản ứng với lượng dư dd HCL 1,5M 𝐚) Tính thể tích dung dịch HCL đã dùng, biết lượng HCL dư 15% 𝐛) Tính nồng độ mol các chất có trong dung dịch sau phản ứng.
a, Ta có: \(n_{KOH}=0,15.2=0,3\left(mol\right)\)
PT: \(KOH+HCl\rightarrow KCl+H_2O\)
Theo PT: \(n_{HCl\left(pư\right)}=n_{KOH}=0,3\left(mol\right)\)
Mà: HCl dư 15%
\(\Rightarrow n_{HCl}=0,3+0,3.15\%=0,345\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,345}{1,5}=0,23\left(l\right)\)
b, Theo PT: \(n_{KCl}=n_{KOH}=0,3\left(mol\right)\)
\(\Rightarrow C_{M_{KCl}}=\dfrac{0,3}{0,15+0,23}\approx0,789\left(M\right)\)
\(C_{M_{HCl\left(dư\right)}}=\dfrac{0,3.15\%}{0,15+0,23}\approx0,118\left(M\right)\)
Đúng 3
Bình luận (0)
Bài 1. Cho 200ml dd KOH 0,5M tác dụng với 100ml dung dịch H2SO4 (x)M.
a. Viết PTHH của phản ứng hóa học xảy ra.
b. Tính nồng độ mol của dung dịch H2SO4 đã dùng.
c. Tính nồng độ mol của dung dịch muối thu được sau phản ứng.
PTHH: \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
Ta có: \(n_{KOH}=0,2\cdot0,5=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4}=n_{K_2SO_4}=0,05\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{H_2SO_4}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\\C_{M_{K_2SO_4}}=\dfrac{0,05}{0,2+0,1}\approx0,17\left(M\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Bài 1 :
200ml = 0,2l
100ml = 0,1l
\(n_{KOH}=0,5.0,2=0,1\left(mol\right)\)
a) Pt : \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O|\)
2 1 1 2
0,1 0,05 0,05
b) \(n_{H2SO4}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
\(C_{M_{ddH2SO4}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
c) \(n_{K2SO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(V_{ddspu}=0,2+0,1=0,3\left(l\right)\)
\(C_{M_{K2SO4}}=\dfrac{0,05}{0,3}=\dfrac{1}{6}\left(M\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Cho 200ml dd acetic acid tác dụng hoàn toàn với 10,6g Sodium carbonate thì thu được chất khí A.
a. Tính thể tích khí A thu được ở đkc và nồng độ mol của dd acetic acid đã dùng.
b. Tính nồng độ mol của dd thu được sau phản ứng.
\(n_{Na2CO3}=\dfrac{10,6}{106}=0,1\left(mol\right)\)
\(2CH_3COOH+Na_2CO_3\rightarrow2CH3OONa+CO_2+H_2O\)
0,2 0,1 0,2 0,1
a) \(V_{CO2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
\(C_{MCH3COOH}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
b) \(C_{MCH3COONa}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Chúc bạn học tốt
Đúng 3
Bình luận (0)
cho 5,4g nhôm Al tác dụng vừa đủ với 200ml dd HCl
a)Tính nồng độ mol của axit HCl
b)Xác định thể tích khí tạo thành ở điều kiện chuẩn
c)Tính nồng độ mol chất tan có trong dd sau, phản ứng biết thể tích dd thay đổi không đáng kể
a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
_____0,2-->0,6----->0,2---->0,3
=> \(C_{M\left(HCl\right)}=\dfrac{0,6}{0,2}=3M\)
b) VH2 = 0,3.24,79 = 7,437 (l)
c) \(C_{M\left(AlCl_3\right)}=\dfrac{0,2}{0,2}=1M\)
Đúng 0
Bình luận (0)
Cho 200ml dd K2SO4 2M tác dụng với 300ml dd BaCl2 1M. Sau khi phản ứng xảy ra hoàn toàn thu được chất không tan A và dd B.a) Viết phương trình phản ứng.b) Tính khối lượng chất kết tủa A.c) Tính nồng độ mol của các chất có trong dd B. Biết thể tích của dd thay đổi không đáng kể.
Xem chi tiết
a)
$K_2SO_4 + BaCl_2 \to BaSO_4 + 2KCl$
b)
$n_{K_2SO_4} = 0,2.2 = 0,4(mol)$
$n_{BaCl_2} = 0,3.1 = 0,3(mol)$
Ta thấy :
$n_{K_2SO_4} : 1 > n_{BaCl_2} : 1$ nên $K_2SO_4$ dư
$n_{BaSO_4} = n_{BaCl_2} = 0,3(mol)$
$m_{BaSO_4} = 0,3.233 = 69,9(gam)$
c) $n_{K_2SO_4} = 0,4 - 0,3 = 0,1(mol)$
$V_{dd\ sau\ pư} = 0,2 + 0,3 = 0,5(lít)$
$C_{M_{K_2SO_4} } = \dfrac{0,1}{0,5} = 0,2M$
$C_{M_{KCl}} = \dfrac{0,6}{0,5} = 1,2M$
Đúng 1
Bình luận (0)
Bài 23. Sục V(l) CO2(đkc) vào 150ml dd Ba(OH)2 1M, sau phản ứng thu được 19,7g kết tủa. Tìm V. Bài 24. Cho 2,24 lít khí CO2 (đkc) tác dụng vừa đủ với 200ml dd Ca(OH)2 sinh ra chất kết tủa trắng. Tính nồng độ mol/lít của dung dịch Ca(OH)2 Bài 25. Hấp thụ hoàn toàn a mol khí CO2 vào dung dịch chứa b mol Ca(OH)2 thì thu được hỗn hợp 2 muối CaCO3 và Ca(HCO3)2. Tìm mối liên hệ giữa a và b.Bài 26. Hấp thụ hoàn toàn 2,688 lít khí CO2(đkc) vào 2,5 lít dd Ba(OH)2 nồng độ a mol/lít,thu được 15,76g kết...
Đọc tiếp
Bài 23. Sục V(l) CO2(đkc) vào 150ml dd Ba(OH)2 1M, sau phản ứng thu được 19,7g kết tủa. Tìm V.
Bài 24. Cho 2,24 lít khí CO2 (đkc) tác dụng vừa đủ với 200ml dd Ca(OH)2 sinh ra chất kết tủa trắng. Tính nồng độ mol/lít của dung dịch Ca(OH)2
Bài 25. Hấp thụ hoàn toàn a mol khí CO2 vào dung dịch chứa b mol Ca(OH)2 thì thu được hỗn hợp 2 muối CaCO3 và Ca(HCO3)2. Tìm mối liên hệ giữa a và b.
Bài 26. Hấp thụ hoàn toàn 2,688 lít khí CO2(đkc) vào 2,5 lít dd Ba(OH)2 nồng độ a mol/lít,thu được 15,76g kết tủa .Tìm a.
Bài 27. Hấp thụ hoàn toàn 2,24 lít CO2(đkc)vào dd nước vôi trong có chứa 0,25 mol Ca(OH)2. Xác định sản phẩm muối thu được sau phản ứng.
ai trả lời hết tôi tick cho nhiều câu trả lời khác
Bài 23 :
n BaCO3 = 0,1(mol) > n Ba(OH)2 = 0,15 mol
- TH1 : Ba(OH)2 dư
$Ba(OH)_2 + CO_2 \to BaCO_3 + H_2O$
n CO2 = n BaCO3 = 0,1(mol)
=> V = 0,1.22,4 = 2,24 lít
- TH1 : BaCO3 bị hòa tan một phần
$Ba(OH)_2 + CO_2 \to BaCO_3 + H_2O(1)$
$Ba(OH)_2 + 2CO_2 \to Ba(HCO_3)_2(2)$
n CO2(1) = n Ba(OH)2 (1) = n BaCO3 = 0,1(mol)
=> n Ba(OH)2 (2) = 0,15 - 0,1 = 0,05(mol)
=> n CO2 (2) = 2n Ba(OH)2 (2) = 0,1(mol)
=> V = (0,1 + 0,1).22,4 = 4,48 lít
Đúng 3
Bình luận (1)
Bài 24 :
$Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O$
n Ca(OH)2 = n CO2 = 2,24/22,4 = 0,1(mol)
CM Ca(OH)2 = 0,1/0,2 = 0,5M
Bài 27 :
n CO2 = 0,1(mol)
Ta có :
n CO2 / n Ca(OH)2 = 0,1/0,25 = 0,4 < 1
Do đó, sản phẩm muối gồm CaCO3 do Ca(OH)2 dư
Đúng 3
Bình luận (0)
Câu 25 :
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$2CO_2 + Ca(OH)_2 \to Ca(HCO_3)_2$
Vì thu được hai muối nên :
1 < a/b < 2
<=> b < a < 2b
Đúng 3
Bình luận (0)