cho 4 6 gam kim loại m vào lượng nước dư, thu được dung dịch X và thoát ra 2,576 lít khí H2(đktc). Kim loại M là
cho đáp án thôi, khỏi cần trình bày ạ
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg và Al cần vừa đủ 100 gam dung dịch HCl x% thu được dung dịch Y và thoát ra 2,576 lít khí H2 (đktc). Cô cạn dung dịch Y thu được 10,475 gam muối.
a. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b. Tính x
\(a,n_{H_2}=\dfrac{2,576}{22,4}=0,115\left(mol\right)\\ Đặt:n_{Mg}=a\left(mol\right);n_{Al}=b\left(mol\right)\left(a,b>0\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow\left\{{}\begin{matrix}95a+133,5b=10,475\\a+1,5b=0,115\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,04\\b=0,05\end{matrix}\right.\\ \%m_{Mg}=\dfrac{0,04.24}{0,04.24+0,05.27}.100\approx41,558\%\Rightarrow\%m_{Al}\approx58,442\%\\ b,n_{HCl}=2.n_{H_2}=2.0,115=0,23\left(mol\right)\\ \Rightarrow x=C\%_{ddHCl}=\dfrac{0,23.36,5}{100}.100=8,395\%\)
Hỗn hợp X gồm Fe và kim loại M có hóa trị không đổi. Cho 15,2 gam X tác dụng với dung dịch HC1 dư, thấy thoát ra 2,24 lít khí H2 (đktc). Nếu cho lượng X như trên tác dụng với dung dịch HNO3 dư, thu được 4,48 lít khí NO (đktc). Kim loại M là
A. Ag.
B. Cu.
C. Al.
D. Mg.
Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
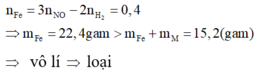
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:

2.2) Khi hòa tan m gam kim loại nhôm vào dung dịch HCl dư thấy V1 lít khí H2(đktc). Nếu cũng lấy m gam kim loại M tác dụng HCl dư thoát ra V2 lít H2(ĐKTC). Biết V1=3,06V2. Tìm kim loại M?
GIÚP T VỚI Ạ!!!
Đặt m = 27 gam → nAl = 1 mol
2Al + 6HCl → 2AlCl3 + 3H2
1 1,5 mol
khối lượng của nhôm và kim loại M bằng nhau → mM = 27 gam
V1 = 3,06 V2 → nH2 (Al) = 3,06.nH2 (M)
→ nH2 (M) = 1,5/3,06 = 0,49 mol
PT: 2M + 2nHCl → 2MCln + nH2
0,98/n 0,49
nM = 0,98/n mol, mM = 27 gam
→ M = \(\dfrac{27n}{0,98}\) ≃ 27,55n
Xét n = 1 → M = 27,55 (loại)
n = 2 → M = 55,1 → M là Mangan (Mn)
Cho 3,37 gam hỗn hợp gồm Na và kim loại kiềm M tác dụng với nước (lấy dư) thu được 2,576 lít khí H2 (đktc). Kim loại M là
A. Li.
B. Cs
C. Rb.
D. K.
Chọn đáp án A
+ Bảo toàn e có nhh kim loại = 2 n H 2 = 0 , 23 mol.
![]()
⇒ M K i m l o ạ i M < 14 , 652 ⇒ M là Li (MLi = 7)
⇒ Chọn A
Cho 3,37 gam hỗn hợp gồm Na và kim loại kiềm M tác dụng với nước (lấy dư) thu được 2,576 lít khí H2 (đktc). Kim loại M là
A. Li
B. Cs
C. Rb
D. K
Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau.
- Cho phần 1 vào dung dịch KOH (dư) thu được 0,784 lít khí H 2 (đktc).
- Cho phần 2 vào một lượng dư H 2 O , thu được 0,448 lít khí H 2 (đktc) và m gam hỗn hợp kim loại Y. Hoà tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H 2 (đktc). Tính khối lượng mỗi kim loại trong mỗi phần.
Cho 13,8 gam hỗn hợp X gồm kim loại kiềm R và Ca tác dụng hết với nước thu được 5,6 lít H2 (đktc) và dung dịch Y. Mặt khác, cho 8,58 gam kim loại R phản ứng hết với lượng dư dung dịch HCl thì thể tích khí H2 thoát ra lớn hơn 2,24 lít (đktc).
1. Tìm kim loại R?
2. Cho 15 lít hỗn hợp khí Z gồm N2 và CO2 (đktc) vào dung dịch Y. Sau khi phản ứng kết thúc thu được 8,5 gam kết tủa. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp Z?
1.
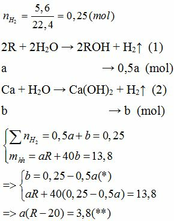
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
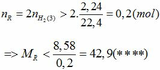
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
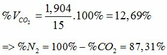
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
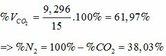
X là hỗn hợp kim loại Ba và Al. Hòa tan m gam X vào lượng dư nước thu được 8.96 lít H2 (đktc). Cũng hòa tan m gam X vào dung dịch NaOH dư thì thu được 12,32 lít khí H2 (đktc). Giá trị của m là:
A. 21,80.
B. 13,70.
C. 57,50.
D.58,85.
X là hỗn hợp kim loại Ba và Al. Hòa tan m gam X vào lượng dư nước thu được 8,96 lít H2 (đktc). Cũng hòa tan m gam X vào dung dịch NaOH dư thì thu được 12,32 lít khí H2 (đktc). Giá trị của m là:
A. 21,80
B. 57,50
C. 13,70
D. 58,85