1 hợp chất X chứa CO2, SO2 khối lượng 26g, thể tích 11,2 lít. Tính khối lượng và thể tích từng khí trong hỗn hợp.

Những câu hỏi liên quan
Hỗn Hợp X gồm các khí SO2 và O2, tỉ khối của X so với H2 là 24. Ở đktc thể tích của hỗ hợp X là 13,44 lít
1. Tính Khối Lượng của Hỗn Hợp X
2. Tính thành phần % theo thể tích mỗi khí có trong X
3. Tính Khối lượng các chất trong X
\(n_{hh}=\dfrac{13,44}{22,4}=0,6mol\)
\(\overline{M_x}=24.2=48\)
\(\left\{{}\begin{matrix}SO_2:64\\O_2:32\end{matrix}\right.\) 48 = \(\dfrac{16}{16}=1\)
\(\Rightarrow n_{SO_2=}n_{O_2}=0,3mol\)
1. \(m_{hh}=0,3.64+0,3.32=28,8g\)
2. \(\%V_{SO_2}=\dfrac{0,3.22,4}{13,44}.100\%=50\%\)
\(\Rightarrow\%V_{O_2}=50\%\)
3. \(m_{SO_2}=0,3.64=19,2g\)
\(m_{O_2}=0,3.32=9,6g\)
Đúng 2
Bình luận (0)
Tính khối lượng từng chất khí trong 9,4g hỗn hợp gồm CO và CO2 biết rằng hỗn hợp khí đó có thể tích là 0, 56 lít
nCO= a (mol) , nCO2 = b (mol)
nhh = 5.6/22.4 = 0.25 (mol)
=> a + b = 0.25
m = 28a + 44b = 9.4 (g)
Khi đó :
a = 0.1 , b = 0.15
mCO = 0.1*28 = 2.8 (g)
mCO2 = 0.15 * 44 = 6.6 (g)
Đúng 0
Bình luận (1)
Hỗn hợp khí A chứa nitơ và hai hiđrocacbon kế tiếp nhau trong một dãy đồng đẳng. Khối lượng hỗn hợp A là 18,3 g và thể tích của nó là 11,2 lít. Trộn A với một lượng dư oxi rồi đốt cháy, thu được 11,7 gam
H
2
O
và 21,28 lít
C
O
2
. Các thể tích đo ở đktc.Hãy xác định công thức phân tử và phần trăm về khối lượng của từng hiđrocacbon trong hỗn hợp A.
Đọc tiếp
Hỗn hợp khí A chứa nitơ và hai hiđrocacbon kế tiếp nhau trong một dãy đồng đẳng. Khối lượng hỗn hợp A là 18,3 g và thể tích của nó là 11,2 lít. Trộn A với một lượng dư oxi rồi đốt cháy, thu được 11,7 gam H 2 O và 21,28 lít C O 2 . Các thể tích đo ở đktc.
Hãy xác định công thức phân tử và phần trăm về khối lượng của từng hiđrocacbon trong hỗn hợp A.
Số mol
C
O
2
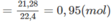
Khối lượng C trong A là: 0,95.12 = 11,4 (g).
Số mol
H
2
O
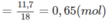
Khối lượng H trong A là: 0,65.2 = 1,3 (g).
Tổng khối lượng của C và H chính là tổng khối lượng 2 hiđrocacbon. Vậy, khối lượng N2 trong hỗn hợp A là : 18,30 - (11,4 + 1,3) = 5,6 (g)
Số mol
N
2
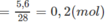
Số mol 2 hidrocacbon 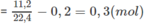
Đặt lượng C x H y là a mol, lượng C x + 1 H y + 2 là b mol :
a + b = 0,2 (1)
Số mol C = số mol C O 2 , do đó :
xa + (x + 1)b = 0,95 (2)
Số mol H = 2.số mol H 2 O , do đó :
ya + (y + 2)b = 2. 0,65= 1,3
Từ (2) ta có x(a + b) + b = 0,95 ⇒ b = 0,95 - 0,3x
Vì 0 < b < 0,3, nên 0 < 0,95 - 0,3x < 0,3
Từ đó tìm được 2,16 < x < 3,16 ⇒ x = 3.
⇒ b = 0,95 − 3.0,3 = 5. 10 - 2
⇒ a = 0,3 − 0,05 = 0,25
Thay giá trị tìm được của a và b vào (3), ta có y = 4.
% về khối lượng của C 3 H 4 trong hỗn hợp A:

% về khối lượng của C 4 H 6 trong hỗn hợp A :

Đúng 0
Bình luận (0)
1. Đốt cháy hoàn toàn X gồm FeS2 FeS bằng không khí (gồm O2 và N2,trong đó O2 chiếm 20% về thể tích) đc Fe2O3 và hỗn hợp khí Y gồm N2,SO2 và O2 trong đó SO2 chiếm 12% và 3,2% về thể tích. Tính % khối lượng của mỗi chất trong X2. Cho 4,92g hỗn hợp X gồm Mg và Al pứ vừa đủ với 4,032 lít (đktc) hỗn hợp khí Y chứa O2 và Cl2 đc 14,97g hỗn hợp các muối và oxit. Xác định thành phần % về khối lượng mỗi chất trong X
Đọc tiếp
1. Đốt cháy hoàn toàn X gồm FeS2 FeS bằng không khí (gồm O2 và N2,trong đó O2 chiếm 20% về thể tích) đc Fe2O3 và hỗn hợp khí Y gồm N2,SO2 và O2 trong đó SO2 chiếm 12% và 3,2% về thể tích. Tính % khối lượng của mỗi chất trong X
2. Cho 4,92g hỗn hợp X gồm Mg và Al pứ vừa đủ với 4,032 lít (đktc) hỗn hợp khí Y chứa O2 và Cl2 đc 14,97g hỗn hợp các muối và oxit. Xác định thành phần % về khối lượng mỗi chất trong X
Hỗn hợp khí A chứa một ankan và một anken, Khối lượng hỗn hợp A là 9 gam và thể tích là 8,96 lít. Đốt cháy hoàn toàn A, thu được 13,44 lít C O 2 . Các thể tích được đo ở đktc.
Xác định công thức phân tử và phần trăm thể tích từng chất trong A.
Khối lượng trung bình của 1 mol A :
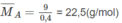
Trong hỗn hợp A phải có chất có M < 22,5 ; chất đó chỉ có thể là C H 4 .
Sau đó giải hệ 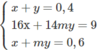
Ta tìm được m = 3; x = 0,3; y = 0,1.
Đúng 0
Bình luận (0)
1. Đốt cháy hoàn toàn X gồm FeS2 FeS bằng không khí (gồm O2 và N2,trong đó O2 chiếm 20% về thể tích) đc Fe2O3 và hỗn hợp khí Y gồm N2,SO2 và O2 trong đó SO2 chiếm 12% và 3,2% về thể tích. Tính % khối lượng của mỗi chất trong X2. Cho 4,92g hỗn hợp X gồm Mg và Al pứ vừa đủ với 4,032 lít (đktc) hỗn hợp khí Y chứa O2 và Cl2 đc 14,97g hỗn hợp các muối và oxit. Xác định thành phần % về khối lượng mỗi chất trong X
Đọc tiếp
1. Đốt cháy hoàn toàn X gồm FeS2 FeS bằng không khí (gồm O2 và N2,trong đó O2 chiếm 20% về thể tích) đc Fe2O3 và hỗn hợp khí Y gồm N2,SO2 và O2 trong đó SO2 chiếm 12% và 3,2% về thể tích. Tính % khối lượng của mỗi chất trong X
2. Cho 4,92g hỗn hợp X gồm Mg và Al pứ vừa đủ với 4,032 lít (đktc) hỗn hợp khí Y chứa O2 và Cl2 đc 14,97g hỗn hợp các muối và oxit. Xác định thành phần % về khối lượng mỗi chất trong X
Dẫn 11,2 lít hỗn hợp gồm C2H4 và CH4 qua bình đựng dd Brom. Thấy khối lượng bình tăng 5,6g.
a. Tính khối lượng của đibrometan?
b. Nếu đốt cháy hoàn toàn hỗn hợp trên. Tính thể tích khí CO2 thoát ra.
(Biết thể tích các khí đều được đo ở ĐKTC)
a) PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{C_2H_4}=\dfrac{5,6}{28}=0,2\left(mol\right)=n_{C_2H_4Br_2}\) \(\Rightarrow m_{C_2H_4Br_2}=0,2\cdot188=37,6\left(g\right)\)
b) Ta có: \(n_{CH_4}=\dfrac{11,2}{22,4}-0,2=0,3\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_4}=0,7\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,7\cdot22,4=15,68\left(l\right)\)
Đúng 1
Bình luận (2)
Hỗn hợp khí A chứa metan, axetilen và propen. Đốt cháy hoàn toàn 11 g hỗn hợp A, thu được 12,6 g H 2 O . Mặt khác, nếu dẫn 11,2 lít A (đktc) qua nước brom (lấy dư) thì khối lượng brom nguyên chất phản ứng tối đa là 100 g.
Hãy xác định thành phần phần trăm theo khối lượng và theo thể tích của từng chất trong hỗn hợp A.
Giả sử trong 11 gam hỗn hợp A có x mol C H 4 , y mol C 2 H 2 và z mol C 3 H 6 :
16x + 26y + 42z = 11 (1)
Khi đốt cháy 11 g A :
C H 4 + 2 O 2 → C O 2 + 2 H 2 O
x mol 2x mol
2 C 2 H 2 + 5 O 2 → 4 C O 2 + 2 H 2 O
y mol y mol
2 C 3 H 6 + 9 O 2 → 6 C O 2 + 6 H 2 O
z mol 3z mol
Số mol H 2 O :
2x + y + 3z = 0,7 (mol) (2)
Số mol A được dẫn qua nước brom là: 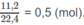
Số mol
B
r
2
đã dự phản ứng: 
Nếu dẫn 11 g A đi qua nước brom :
C H 4 không phản ứng
x mol
C 2 H 2 + 2 B r 2 → C 2 H 2 B r 4
y mol 2y mol
C 3 H 6 + B r 2 → C 3 H 6 B r 2
z mol z mol
Như vậy: (x + y + z) mol A tác dụng với (2y + z) mol B r 2 , 0,500 mol A tác dụng với 0,625 mol B r 2
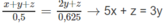
Giải hệ phương trình, tìm được x = 0,1; y = 0,2; z = 0,1
Thành phần phần trăm các chất trong hỗn hợp A:
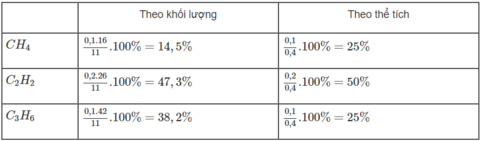
Đúng 0
Bình luận (0)
Hỗn hợp khí A chứa N2 và hai hiđrocacbon kế tiếp nhau trong dãy đồng đẳng. Khối lượng hỗn hợp A là 18,3 gam và thể tích của nó là 11,2 lít. Trộn A với một lượng dư oxi rồi đốt cháy, thu được 11,7 gam H2O và 21,28 lít CO2. Các thể tích khí đo ở điều kiện chuẩn. CTPT của 2 hiđrocacbon là: A. C3H4; C4H6 B. C4H6; C5H8 C. C3H2; C4H4 D. C4H4; C5H6
Đọc tiếp
Hỗn hợp khí A chứa N2 và hai hiđrocacbon kế tiếp nhau trong dãy đồng đẳng. Khối lượng hỗn hợp A là 18,3 gam và thể tích của nó là 11,2 lít. Trộn A với một lượng dư oxi rồi đốt cháy, thu được 11,7 gam H2O và 21,28 lít CO2. Các thể tích khí đo ở điều kiện chuẩn. CTPT của 2 hiđrocacbon là:
A. C3H4; C4H6
B. C4H6; C5H8
C. C3H2; C4H4
D. C4H4; C5H6
















