Cho sơ đồ phản ứng sau Cu+O2- CuO cân bằng đúng nhất là

Những câu hỏi liên quan
B1: Cho sơ đồ phản ứng sau: Cu + O2 - - -> CuO
a, cân bằng sơ đồ phản ứng
b, cho biết: Cu = 12,8
O2 = 3,2
Tính CuO ?
B2: Cân bằng các sơ đồ
a, Na2O + H2O - - ->NaOH
b, Na + H2O - - -> NaOH + H2
c, Cu + O2 - - -> CuO
d, Fe2O3 + Hcl - - -> Fecl3 + H2O
e, Fe2O3 + C - - -> Fe + CO2
g, CaCO3 + Hcl - - -> CaCl2 + Co2 + H2O
B1:
a) \(2Cu+O_2\rightarrow2CuO\)
b) Theo định luật bảo toàn khối lượng, khối lượng CuO thu được là:
\(m_{CuO}=m_{Cu}+m_{O_2}=12,8+3,2=16\)
B2:
a) \(Na_2O+H_2O\rightarrow2NaOH\)
b) \(2Na+2H_2O\rightarrow2NaOH+H_2\)
c) \(2Cu+O_2\rightarrow2CuO\)
d) \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
e) \(2Fe_2O_3+3C\rightarrow4Fe+3CO_2\)
g) \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
Đúng 0
Bình luận (0)
hoàn thành sơ đồ phản ứng (chuỗi phản ứng) sau mỗi mũi tên ứng với một phương trình phản ứng ghi điều kiện (nếu có)
KClO3-> O2->Cuo->Cu
KMnO4->O2->ZnO->Zn
H2->H2O->H2SO4->H2->Cu->CuO
S->SO2->SO3->H2SO4->Al2(SO4)3
\(H_2+\dfrac{1}{2}O_2\xrightarrow[]{t^o}H_2O\)
\(H_2O+SO_3\rightarrow H_2SO_4\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
\(H_2+CuO\xrightarrow[]{t^o}Cu+H_2O\)
\(Cu+\dfrac{1}{2}O_2\xrightarrow[]{t^o}CuO\)
Đúng 4
Bình luận (0)
\(KClO_3\xrightarrow[MnO_2]{t^o}KCl+\dfrac{3}{2}O_2\uparrow\)
\(\dfrac{1}{2}O_2+Cu\xrightarrow[]{t^o}CuO\)
\(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\)
Đúng 3
Bình luận (0)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
\(Zn+\dfrac{1}{2}O_2\xrightarrow[]{t^o}ZnO\)
\(ZnO+CO\xrightarrow[]{t^o}Zn+CO_2\)
Đúng 3
Bình luận (0)
Xem thêm câu trả lời
Đốt cháy hết 12,8 g kim loại đồng Cu trong lọ có chứa 3,2 g khí oxi O2 thu được hợp chất đồng (II) oxit CuO.
theo sơ đồ phản ứng sau: Cu + O2 à CuO. Tính khối lượng của CuO sinh ra.
Theo ĐLBTKL
\(m_{Cu}+m_{O_2}=m_{CuO}\\ =>m_{CuO}=12,8+3,2=16\left(g\right)\)
Đúng 2
Bình luận (1)
Cho cân bằng sau:
C
u
O
(
r
)
+
C
O
(
k
)
→
C
u
(
r
)
+
C
O
2
(
k
)
Đồ thị nào sau đây biểu diễn đúng sự phụ thuộc tốc độ phản ứng vào áp suất:
Đọc tiếp
Cho cân bằng sau:
C u O ( r ) + C O ( k ) → C u ( r ) + C O 2 ( k )
Đồ thị nào sau đây biểu diễn đúng sự phụ thuộc tốc độ phản ứng vào áp suất:
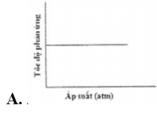

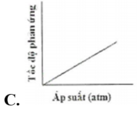
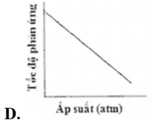
Chú ý câu hỏi sự phụ thuộc của tốc độ phản ứng vào áp suất. Khi áp suất tăng thì tốc độ phản ứng tăng. → Chọn C.
Đúng 0
Bình luận (0)
Cho cân bằng sau: CuO(r) + CO(k) → Cu(r) + CO2(k) Đồ thị nào sau đây biểu diễn đúng sự phụ thuộc tốc độ phản ứng vào áp suất: A. B. C. D.
Đọc tiếp
Cho cân bằng sau:
CuO(r) + CO(k) → Cu(r) + CO2(k)
Đồ thị nào sau đây biểu diễn đúng sự phụ thuộc tốc độ phản ứng vào áp suất:
A. 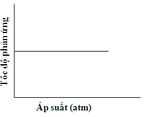
B.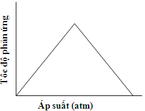
C.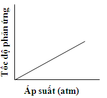
D.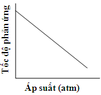
Đáp án C
Chú ý câu hỏi sự phụ thuộc của tốc độ phản ứng vào áp suất. Khi áp suất tăng thì tốc độ phản ứng tăng.
Đúng 0
Bình luận (0)
Lập sơ đồ phản ứng sau và cho biết phản ứng nào thuộc phản ứng hoá hợp, phản ứng nào thuộc phản ứng phân hủy
H2 + O2 -----› H2O
Al + O2------> Al2O3
KClO3 -----> KCl + O2
Cu(OH)2 ------> CuO + H2O
Theo mình thì: hóa hợp, hóa hợp, phân hủy, phân hủy
Đúng 0
Bình luận (0)
Lập sơ đồ phản ứng sau và cho biết phản ứng nào thuộc phản ứng hoá hợp, phản ứng nào thuộc phản ứng phân hủy
\(2H_2+O_2-t^o->2H_2O\uparrow\)
=> Phản ứng hóa hợp
\(4Al+3O_2-t^o->2Al_2O_3\)
=> Phản ứng hóa hợp
\(2KClO_3-t^o->2KCl+3O_2\uparrow\)
=> Phản ứng phân hủy
\(Cu\left(OH\right)_2-t^o->CuO+H_2O\uparrow\)
=> Phản ứng phân hủy
Đúng 0
Bình luận (0)
2H2 + O2 \(\underrightarrow{to}\) 2H2O
\(\rightarrow\) Phản ứng hóa hợp
4Al + 3O2 \(\underrightarrow{to}\) 2Al2O3
\(\rightarrow\) Phản ứng hóa hợp
2KClO3 \(\underrightarrow{to}\)2KCl + 3O2
\(\rightarrow\) Phản ứng phân hủy
Cu(OH)2 \(\underrightarrow{to}\) CuO+ H2O
\(\rightarrow\) Phản ứng phân hủy
Đúng 0
Bình luận (0)
Cho sơ đồ phản ứng sau: P+O2-->P2O5. Sau khi cân bằng, tỉ lệ số nguyên tử P: số phân tử O2: số phân tử P2O5 Là
Câu 6. Hoàn thành các sơ đồ phản ứng sau: a. Fe + O2 -----> Fe3O4 b. P + O2 -----> P2O5 c. Al2O3 + H2SO4 -----> Al2(SO4)3 + H2O d. Fe2O3 + H2SO4 -----> Fe2(SO4)3 + H2O e. Cu(NO3)2 -----> CuO + NO2 + O2
a) 3Fe +2 O2 --to--> Fe3O4
b) 4P + 5O2 --to--> 2P2O5
c) Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
d) Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
e) 2Cu(NO3)2 --to--> 2CuO + 4NO2 + O2
Đúng 1
Bình luận (0)
\(a,3Fe+2O_2\xrightarrow{t^o}Fe_3O_4\\ b,4P+5O_2\xrightarrow{t^o}2P_2O_5\\ c,Al_2O_3+3H_2SO_4\to Al_2(SO_4)_3+3H_2O\\ d,Fe_2O_3+3H_2SO_4\to Fe_2(SO_4)_3+3H_2O\\ e,2Cu(NO_3)_2\xrightarrow{t^o}2CuO+4NO_2+O_2\uparrow\)
Đúng 0
Bình luận (0)
Cho sơ đồ phản ứng sau: NH3
→
t
∘
,
x
t
+
O
2
NO
→
+
O
2
NO2
→
+
O
2...
Đọc tiếp
Cho sơ đồ phản ứng sau:
NH3 → t ∘ , x t + O 2 NO → + O 2 NO2 → + O 2 + H 2 O HNO3 → + C a O Cu(NO3)2 → t ∘ NO2.
Mỗi mũi tên là một phản ứng hóa học. Số phản ứng oxi hóa – khử trong chuỗi trên là
A. 3
B. 4.
C. 5
D. 2
Chọn B.
Xác định số oxi hoá của nitơ trong các hợp chất. Nếu có sự thay đổi số oxi hoá qua từng phản ứng thì xảy ra phản ứng oxi hoá khử.
Trừ phản ứng HNO3 ra Cu(NO3)2 còn lại đều là phản ứng oxi hóa – khử
Đúng 1
Bình luận (0)





















