
Những câu hỏi liên quan
Anh chị làm ơn giúp e mấy bài này ạ.E cảm ơn!Bài 1:Khi đốt cháy hoàn toàn một lượng hợp chất hữu cơ X cần 0,8 gam O2 người ta thu được 1,1 gam CO2,0,45 gam H2O và không có sản phẩm nào khác. Xác định công thức phân tử của X. Biết rằng khi cho bay hơi hoàn toàn 0,6gam X ở điều kiện nhiệt độ và áp suất thích hợp đã thu được một thể tích hơi đúng bằng thể tích hơi của 0,32 gam O2 trong cùng điều kiện.Bài 2:Đốt cháy hoàn toàn một hợp chất hữu cơ A có thành phần C,H,O thu được CO2 có thể tích bằng 3/...
Đọc tiếp
Anh chị làm ơn giúp e mấy bài này ạ.E cảm ơn!
Bài 1:
Khi đốt cháy hoàn toàn một lượng hợp chất hữu cơ X cần 0,8 gam O2 người ta thu được 1,1 gam CO2,0,45 gam H2O và không có sản phẩm nào khác. Xác định công thức phân tử của X. Biết rằng khi cho bay hơi hoàn toàn 0,6gam X ở điều kiện nhiệt độ và áp suất thích hợp đã thu được một thể tích hơi đúng bằng thể tích hơi của 0,32 gam O2 trong cùng điều kiện.
Bài 2:
Đốt cháy hoàn toàn một hợp chất hữu cơ A có thành phần C,H,O thu được CO2 có thể tích bằng 3/4 thể tích hơi nước và bằng 6/7 thể tích O2 dùng để đốt cháy. Mặt khác, 1l hơi A có khối lượng bằng 46 lần khối lượng 1 lít H2 ở cùng điều kiện.Tìm công thức phân tử của A.
Bài 3: Đốt cháy hoàn toàn 4,3 gam hợp chất hữu cơ thu được 6,72 lít CO2 và 0,35 mol H2O. Khi đốt cháy hoàn toàn 1 mol chất A cần 212,8l O2.Xác định CTPT của A.
Đốt cháy hoàn toàn a(g) HCHC A cần vừa đủ 6,72 lít O2 thu đc 13,2g CO2 và 5,4g H2O.
a) Tính a và % khối lượng các nguyên tố trong A
b) Biết tỉ khối hơi của A so với không khí cân bằng 1,0345. Xác định CTPT của A
2. Đốt cháy hoàn toàn 1,72g một chất hữu cơ A chứa C,H,N thì thu dc 3,52g CO2; 0,1mol H2O và 448cm^3 khí N2(đkc). Khi hóa hơi 1,29g chất A thì có thể bằng đúng thể tích 0,96g oxi cùng đk.
Xem chi tiết
A + O2 --> CO2 + H2O
nCO2 = \(\dfrac{13,2}{44}\)= 0,3 mol = nC
nH2O = \(\dfrac{5,4}{18}\)= 0,3 mol => nH = 0,3 .2 = 0,6 mol
nO2 = 6,72/22,4 = 0,3 mol
Áp dụng định luật BTKL : mA + mO2 = mCO2 + mH2O
=> mA = 13,2 + 5,4 - 0,3.32 = 9 gam
mC + mH = 0,3.12 + 0,6 = 4,2 < 9
=> Trong A có C ; H và O
mO = mA - mC - mH = 4,8 gam
%mC = \(\dfrac{0,3.12}{9}\).100% = 40% %mH = \(\dfrac{0,6}{9}\).100% = 6,67%
=>%mO = 100 - 40 - 6,67 = 53,33%
b) nO = \(\dfrac{4,8}{16}\)= 0,3 mol
Gọi CTĐGN của A là CxHyOz => x : y : z = nC : nH : nO = 1:2:1
=> CTPT của A có dạng (CH2O)n
MA = 1,0345.29 = 30 g/mol
=> n = 1 và CTPT của A là CH2O
Đúng 2
Bình luận (0)
Bài 2 :
nC = nCO2 = \(\dfrac{3,52}{44}\)= 0,08 mol ; nN = 2nN2 = \(\dfrac{0,448.2}{22,4}\)= 0,04 mol
nH = 2nH2O = 0,2 mol
Gọi CTĐGN của A là CxHyNt
=> x : y : t = nC : nH : nN = 2 : 5 : 1
CTPT của A có dạng (C2H5N)n
mà 1,29 gam A có thể tích = 0,96 gam oxi ở cùng đk
=> 1,29 gam A có số mol = 0,96 gam oxi ở cùng đk = \(\dfrac{0,96}{32}\)=0,03 mol
=> MA = \(\dfrac{1,29}{0,03}\)= 43 g/mol
=> (12.2 + 5 + 14)n = 43 <=> n = 1 và A có CTPT là C2H5N
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn chất hữu cơ A có tỉ lệ khối lượng mC : mO = 3 : 2, thu được khí CO2 và hơi nước theo tỉ lệ thể tích CO2 : H2O = 4 : 3 ở cùng nhiệt độ và áp suất. Xác định CTPT của A
Tỉ lệ về thể tích bằng tỉ lệ về số mol
Coi $n_{CO_2} = 4(mol) \Rightarrow n_{H_2O} = 3(mol)$
Bảo toàn nguyên tố C, H :
$n_C = n_{CO_2} = 4(mol) ; n_H = 2n_{H_2O} = 6(mol)$
$m_C = 4.12 = 48(gam)$
$\Rightarrow m_O = 48.\dfrac{2}{3} = 32(gam)$
$\Rightarrow n_O = \dfrac{32}{16} = 2(mol)$
Ta có :
$n_C : n_H : n_O = 4 : 6 : 2 = 2 : 3 : 1$
Vậy CTPT của A là $(C_2H_3O)_n$
Với n = 2 thì tồn tại CTCT : $OH-CH_2-C \equiv C-CH_2-OH$
Vậy CTPT là $C_2H_6O_2$
Đúng 2
Bình luận (0)
Để đốt cháy hoàn toàn 1,88 gam chất X cần một lượng vừa đủ 1,904 lít O2 ( đktc), sản phẩm cháy là CO2 và hơi H2O với tỉ lệ thể tích của CO2: H2O là 4: 3. Để xác định khối lượng phân tử của X, người ta hòa tan 18,8 gam X vào 250 gam benzen, sau đó làm lạnh thấy nhiệt độ đông đặc của dung dịch giảm 2,080 C so với benzen nguyên chất. Biết hằng số nghiệm lạnh của benzen là 5,2. Xác định CTPT của X.
Đọc tiếp
Để đốt cháy hoàn toàn 1,88 gam chất X cần một lượng vừa đủ 1,904 lít O2 ( đktc), sản phẩm cháy là CO2 và hơi H2O với tỉ lệ thể tích của CO2: H2O là 4: 3. Để xác định khối lượng phân tử của X, người ta hòa tan 18,8 gam X vào 250 gam benzen, sau đó làm lạnh thấy nhiệt độ đông đặc của dung dịch giảm 2,080 C so với benzen nguyên chất. Biết hằng số nghiệm lạnh của benzen là 5,2. Xác định CTPT của X.
Đốt cháy hoàn toàn 2,20 g chất hữu cơ A, người ta thu được 4,40 g
C
O
2
và 1,80 g
H
2
O
.1. Xác định công thức đơn giản nhất của chất A.2. Xác định công thức phân tử chất A biết rằng nếu làm bay hơi 1,10 g chất A thì thể tích hơi thu được đúng bằng thể tích của 0,40 g khí
O
2
ở cùng nhiệt độ và áp suất.
Đọc tiếp
Đốt cháy hoàn toàn 2,20 g chất hữu cơ A, người ta thu được 4,40 g C O 2 và 1,80 g H 2 O .
1. Xác định công thức đơn giản nhất của chất A.
2. Xác định công thức phân tử chất A biết rằng nếu làm bay hơi 1,10 g chất A thì thể tích hơi thu được đúng bằng thể tích của 0,40 g khí O 2 ở cùng nhiệt độ và áp suất.
1. C 2 H 4 O .
2. Số mol A trong 1,10 g A = số mol O 2 trong 0,40 g O 2
n
O
2

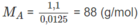
( C 2 H 4 O ) n = 88 ⇒ 44n = 88 ⇒ n = 2
CTPT là C 4 H 8 O 2 .
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 1,47 gam chất hữu cơ X (chỉ chứa C, H, O) bằng 1,0976 lít khí O2 (ở đktc) lượng dùng vừa đủ, sau thí nghiệm thu được H2O, 2,156 gam CO2. Tìm CTPT của X, biết tỉ khối hơi của X so với không khí nằm trong khoảng 3 dX 4. A. C4H10O3 B. C3H4O3 C. C3H6O3 D. C3H8O3
Đọc tiếp
Đốt cháy hoàn toàn 1,47 gam chất hữu cơ X (chỉ chứa C, H, O) bằng 1,0976 lít khí O2 (ở đktc) lượng dùng vừa đủ, sau thí nghiệm thu được H2O, 2,156 gam CO2. Tìm CTPT của X, biết tỉ khối hơi của X so với không khí nằm trong khoảng 3< dX < 4.
A. C4H10O3
B. C3H4O3
C. C3H6O3
D. C3H8O3
2. Đốt cháy hoàn toàn 23 gam hợp chất A cần 33,6 lít ôxi (đktc) và thu được thể tích CO2 bằng 2/3 thể tích hơi nước . Xác định CTHH của A. Biết rằng tỉ khối hơi của A so với khí ôxi là 1,4375.
Do đốt cháy A thu được sản phẩm chứa C, H, O
=> Trong A chứa C, H và có thể có O
Gọi \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{2}{3}a\left(mol\right)\\n_{H_2O}=a\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
Theo ĐLBTKL: \(44.\dfrac{2}{3}a+18a=23+1,5.32=71\)
=> a = 1,5 (mol)
=> \(\left\{{}\begin{matrix}n_C=n_{CO_2}=1\left(mol\right)\\n_H=2.n_{H_2O}=3\left(mol\right)\end{matrix}\right.\)
=> \(n_O=\dfrac{23-1.12-3.1}{16}=0,5\left(mol\right)\)
Xét nC : nH : nO = 1 : 3 : 0,5 = 2 : 6 : 1
=> CTPT: (C2H6O)n
Mà MA = 1,4375.32 = 46 (g/mol)
=> n = 1
=> CTPT: C2H6O
Đúng 3
Bình luận (0)
\(n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\\ m_{O_2}=1,5.32=48\left(g\right)\)
Bảo toàn khối lượng: mH2O + mCO2 = mA + mO2 = 23 + 48 = 71 (g)
Ta có:
\(\dfrac{V_{CO_2}}{V_{H_2O}}=\dfrac{2}{3}\Rightarrow\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{2}{3}\\ \Rightarrow\dfrac{m_{CO_2}}{m_{H_2O}}=\dfrac{2}{3}.\dfrac{44}{18}=\dfrac{44}{27}\\ \Rightarrow\dfrac{m_{CO_2}}{44}=\dfrac{m_{H_2O}}{27}\)
Theo t/c của dãy tỉ số bằng nhau:
\(\dfrac{m_{CO_2}}{44}=\dfrac{m_{H_2O}}{27}=\dfrac{m_{CO_2}+m_{H_2O}}{44+27}=\dfrac{71}{71}=1\)
=> \(\left\{{}\begin{matrix}m_{CO_2}=1.44=44\left(g\right)\\m_{H_2O}=1.27=27\left(g\right)\end{matrix}\right.\)
Bảo toàn C và H: \(\left\{{}\begin{matrix}n_C=n_{CO_2}=\dfrac{44}{44}=1\left(mol\right)\\n_H=2n_{H_2O}=\dfrac{2.27}{18}=3\left(mol\right)\end{matrix}\right.\)
Bảo toàn O: \(n_O=\dfrac{23-12-3}{16}=0,5\left(mol\right)\)
MA = 1,4375.32 = 46 (g/mol)
CTPT của A có dạng: CxHyOz
=> x : y : z = 1 : 3 : 0,5 = 2 : 6 : 1
=> (C2H6O)n = 46
=> n = 1
=> CTPT của A là C2H6O
Đúng 2
Bình luận (1)
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít
O
2
. Sản phẩm thu được chỉ gồm có 1,80 g
H
2
O
và 2,24 lít
C
O
2
. Các thể tích khí đo ở đktc.1. Xác định công thức đơn giản nhất của A.2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.3. Xác định công thức cấu tạo có thể có của chất A, ghi...
Đọc tiếp
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít O 2 . Sản phẩm thu được chỉ gồm có 1,80 g H 2 O và 2,24 lít C O 2 . Các thể tích khí đo ở đktc.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
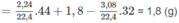
Khối lượng C trong 1,8 g A là: 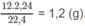
Khối lượng H trong 1,8 g A là: 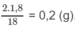
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
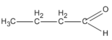 (butanal)
(butanal)
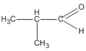 (2-metylpropanal)
(2-metylpropanal)
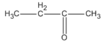 (butan-2-ol)
(butan-2-ol)
Đúng 0
Bình luận (0)
Hỗn hợp X chứa ba chất hữụ cơ đồng phân. Nếu làm bay hơi 2,10 g X thì thể tích hơi thu được bằng thể tích của 1,54 g khí
C
O
2
ở cùng điều kiện. Để đốt cháy hoàn toàn 1,50 g X cần dùng vừa hết 2,52 lít
O
2
(đktc). Sản phẩm cháy chỉ có
C
O
2
và
H
2
O
theo tỉ lệ 11 : 6 về khối lượng.1. Xác định cô...
Đọc tiếp
Hỗn hợp X chứa ba chất hữụ cơ đồng phân. Nếu làm bay hơi 2,10 g X thì thể tích hơi thu được bằng thể tích của 1,54 g khí C O 2 ở cùng điều kiện. Để đốt cháy hoàn toàn 1,50 g X cần dùng vừa hết 2,52 lít O 2 (đktc). Sản phẩm cháy chỉ có C O 2 và H 2 O theo tỉ lệ 11 : 6 về khối lượng.
1. Xác định công thức phân tử của ba chất trong X.
2. Dựa vào thuyết cấu tạo hoá học, hãy viết công thức cấu tạo (triển khai và rút gọn) của từng chất đó.
Ba chất đồng phân có công thức phân tử giống nhau. Đốt X ta chỉ được C O 2 và H 2 O , vậy các chất trong X có chứa C, H và có thể có chứa O.
Theo định luật bảo toàn khối lượng :
m C O 2 + m H 2 O = m X + m O 2 = 5,1(g)
Mặt khác mCO2: mH2O = 11:6
Từ đó tìm được: m C O 2 = 3,30 g và m H 2 O = 1,80 g
Khối lượng C trong 3,30 g
C
O
2
: 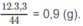
Khối lương H trong 1,80 g
H
2
O
: 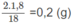
Khối lượng O trong 1,50 g X : 1,50 - 0,9 - 0,2 = 0,4 (g).
Các chất trong X có dạng C x H y O z
x : y : z = 0,075 : 0,2 : 0,025 = 3 : 8 : 1.
Công thức đơn giản nhất là C 3 H 8 O .
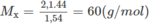
⇒ CTPT cũng là C 3 H 8 O .
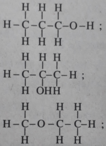
Đúng 0
Bình luận (0)













