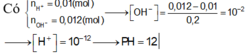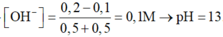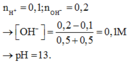pH của dung dịch Ba(Ọ)2 0.04M là

Những câu hỏi liên quan
Tính nồng độ mol của các ion, tính pH của dung dịch trong các trường hợp
1)Trộn 1 lít dung dịch H2SO4 0.03M với 4 lít dung dịch HCl 0.04M
2) Trộn 2 lít dung dịch NaOH 0.03M với 3 lít dung dịch Ba(OH)2 0.01M
1) Ta coi H2SO4 điện li mạnh hai nấc.
\(n_{H_2SO_4}=0,03\) mol; \(n_{HCl}=0,16\) mol
\(H_2SO_4\rightarrow2H^++SO_4^-\)
0,03 -----> 0,06 ---> 0,03
\(HCl\rightarrow H^++Cl^-\)
0,16 --> 0,16 --> 0,16
\(\Rightarrow n_{H^+}=2n_{H_2SO_4}+n_{HCl}=2.0,03+0,16=0,22\) mol
+ \(\left[H^+\right]=\dfrac{0,22}{1+4}=0,044\) mol/lít
\(\Rightarrow pH=-lg\left[H^+\right]=-lg0,044=1,36\)
+ \(\left[SO_4^-\right]=\dfrac{0,03}{1+4}=6.10^{-3}\) mol/lít
+ \(\left[Cl^-\right]=\dfrac{0,16}{1+4}=0,032\) mol/lít
2) + \(n_{OH^-}=n_{NaOH}+2n_{Ba\left(OH\right)_2}=0,12\) mol
\(\Rightarrow\left[OH^-\right]=\dfrac{0,12}{5}=0,024\) mol/lít
\(\Rightarrow pOH=-lg\left[OH^-\right]=1,62\)
\(\Rightarrow pH=14-pOH=12,38\)
+ \(n_{Na^+}=n_{NaOH}=0,06\) mol
\(\Rightarrow\left[Na^+\right]=\dfrac{0,06}{5}=0,012\) mol/lít
+ \(n_{Ba^{2+}}=n_{Ba\left(OH\right)_2}=0,03\) mol
\(\Rightarrow\left[Ba^{2+}\right]=\dfrac{0,03}{5}=0,006\) mol/lít
Đúng 0
Bình luận (0)
Cho 100 ml dung dịch hỗn hợp A gồm H2SO4 0,015M; HCl 0,03M; HNO3 0,04M. Tính thể tích dung
dịch NaOH 0,2M để trung hòa hết 200ml dung dịch A.
Câu 22. Cho 100 ml dung dịch hỗn hợp X gồm Ba(OH)2 0.015M; NaOH 0.03 M; KOH 0.04M. Tính thể tích dung
dịch HCl 0.2M để trung hòa dung dịch X.
Trong 100 ml thì :
\(n_{H^+}=0.1\cdot\left(0.015\cdot2+0.03+0.04\right)=0.01\left(mol\right)\)
Trong 200 ml :
\(n_{H^+}=0.01\cdot2=0.02\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.02.......0.02\)
\(V_{dd_{NaOH}}=\dfrac{0.02}{0.2}=0.1\left(l\right)\)
Đúng 1
Bình luận (0)
\(n_{OH^-}=0.1\cdot\left(0.015\cdot2+0.03+0.04\right)=0.01\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.01.......0.01\)
\(V_{dd_{HCl}}=\dfrac{0.01}{0.2}=0.05\left(l\right)\)
Đúng 1
Bình luận (0)
Giúp mình giải mẫu 2 bài này xác định nồng độ các ion Trộn 100 ml dung dikch HCL 0.1M với 300ml dung dịch HCl 0.04M Trộn 100ml dung dịch HNO3 0.1M với 400ml dung dịch H2SO4 0.03M
Trộn 100 ml dung dikch HCL 0.1M với 300ml dung dịch HCl 0.04M
\(n_{HCl}=0,1.0,1=0,01\left(mol\right);n_{HCl}=0,3.0,04=0,012\left(mol\right)\)
Dung dịch gồm H+ và Cl-
\(n_{H^+}=0,01+0,012=0,022\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,022}{0,4}=0,055M\)
\(n_{Cl^-}=0,01+0,012=0,022\left(mol\right)\)
=>\(\left[Cl^-\right]=\dfrac{0,022}{0,4}=0,055M\)
Trộn 100ml dung dịch HNO3 0.1M với 400ml dung dịch H2SO4 0.03M
\(n_{HNO_3}=0,1.0,1=0,01\left(mol\right);n_{H_2SO_4}=0,04.0,3=0,012\left(mol\right)\)
Dung dịch sau khi trộn gồm :
\(n_{H^+}=0,01+0,012.2=0,034\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,034}{0,5}=0,068M\)
\(n_{NO_3^-}=0,01\left(mol\right)\)
=>\(\left[NO_3^-\right]=\dfrac{0,01}{0,5}=0,02M\)
\(n_{SO_4^{2-}}=0,012\left(mol\right)\)
=> \(\left[SO_4^{2-}\right]=\dfrac{0,012}{0,5}=0,024M\)
Đúng 2
Bình luận (0)
Giúp mình giải mẫu 1 câu này trộn 100 ml dung dịch HCl 0.1M với 300ml dung dịch HCl 0.04M
1.Để trung hòa Vml dung dịch H2SO4 0,5M cần 100ml dung dịch chứa gồm Ca(OH)2 0.04M và NaOH 00.04M. Tính giá trị của V?
2. Có 250ml dd HCL 0,40M. Hỏi phải thêm bao nhiêu nước vào dd này để được dd có pH=1?
Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là:Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là: A. 13 B. 2 C. 12 D. 7
Đọc tiếp
Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là:Cho 100ml dung dịch HCl 0,1M vào 100ml dung dịch Ba(OH)2 0,06M thu được 200ml dung dịch X. Giá trị pH của dung dịch X là:
A. 13
B. 2
C. 12
D. 7
Trộn 500 ml dung dịch HNO3 0,2M với 500 ml dung dịch Ba(OH)2 0,2M. pH của dung dịch thu được là
A. 13.
B. 12.
C. 7.
D. 1.
Trộn dung dịch HCl 0,2M và dung dịch Ba(OH)2 0,2M có V bằng nhau. pH của dung dịch thu được là:
A. 12,5
B. 5
C. 13
D. 11,2
Đáp án C
2 dung dịch có thể tích bằng nhau ⇒ nOH-/ Ba(OH)2 = 2nH+/ HCl
H+ + OH- → H2O
0,2V 0,4V (mol)
Phản ứng : 0,2V → 0,2V (mol)
⇒ Trong dung dịch thu được có OH- dư
Trộn 2 dung dịch có cùng thể tích ⇒ [OH-] dư = 0,2 : 2 = 0,1M
⇒ pH = 13.
Đáp án C.
Đúng 0
Bình luận (0)
Trộn 500 ml dung dịch HNO3 0,2M với 500 ml dung dịch Ba(OH)2 0,2M. pH của dung dịch thu được là A. 13. B. 12. C. 7. D. 1.
Đọc tiếp
Trộn 500 ml dung dịch HNO3 0,2M với 500 ml dung dịch Ba(OH)2 0,2M. pH của dung dịch thu được là
A. 13.
B. 12.
C. 7.
D. 1.