Cho biết tổng số các hạt proton, nơtron, electron tạo nên một nguyên tử một nguyên tố bằng 49, trong đó số hạt không mang điện là 17. Số lớp electron và số electron lớp ngoài cùng có gì giống và khác so với nguyên tử O?

Những câu hỏi liên quan
Cho biết tổng số các hạt proton, nơtron, electron tạo nên một nguyên tử một nguyên tố bằng 49, trong đó số hạt không mang điện là 17. Tính số p và số e có trong nguyên tử.
Trong 1 nguyên tử có số p = số e và nơtron là hạt không mang điện.
Theo đề bài, ta có: n = 17
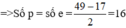
Vậy số p và số e bằng 16.
Đúng 1
Bình luận (0)
Theo bài ra ta có :
2p + n = 49 (p=e) (1)
Mặt khác số hạt không mang điện là 17 => n=17 (2)
Thay (2) vào (1) ta được:
2p+17=49
=> 2p = 49-17=32
=> p=e= 32:2= 16
Vậy số p= số e = 16
Đúng 0
Bình luận (0)
Cho biết tổng số các hạt proton, nơtron, electron tạo nên một nguyên tử một nguyên tố bằng 49, trong đó số hạt không mang điện là 17. Viết tên, kí hiệu hóa học và nguyên tử khối của nguyên tố.
Nguyên tố này là lưu huỳnh, kí hiệu S, nguyên tử khối là 32 đvC.
Đúng 0
Bình luận (0)
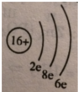
Cho biết tổng số các hạt proton, nơtron, electron tạo nên một nguyên tử một nguyên tố bằng 49, trong đó số hạt không mang điện là 17. Vẽ sơ đồ đơn giản của nguyên tử.
Nguyên tử nguyên tố X có tổng số hạt (proton, nơtron, electron) là 115, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Cấu hình electron lớp ngoài cùng của X là A.
4
s
2
B.
4
s
2
4
p
5
C.
3
s
2
3
p
5
D.
3...
Đọc tiếp
Nguyên tử nguyên tố X có tổng số hạt (proton, nơtron, electron) là 115, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Cấu hình electron lớp ngoài cùng của X là
A. 4 s 2
B. 4 s 2 4 p 5
C. 3 s 2 3 p 5
D. 3 d 10 4 s 1
B
Gọi số proton, nơtron và electron của X là p, n và e (trong đó p = e)
Theo bài ra ta có hệ phương trình:
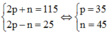
=> Cấu hình nguyên tử của X là
![]()
Đúng 0
Bình luận (0)
Câu 1: Cho biết tổng số hạt proton, nơtron, electron tạo nên nguyên tử của một nguyên tố bằng 49. Trong đó số hạt không mang điện là 17.
Tính số p, e trong nguyên tử, viết tên, kí hiệu hóa học và nguyên tử khối của nguyên tố.
Câu 2: Biết 1đvC = 1u= 1,6605.10-24g. Tính khối lượng của các nguyên tử Fe, O ra gam.
Một nguyên tử nguyên tố X có tổng số hạt electron, proton và nơtron là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10.
a) Tính số hạt electron, proton và nơtron trong nguyên tử X.
b) Cho biết tên gọi, kí hiệu hoá học và nguyên tử khối của X.
a) Theo đề bài ta có: \(p+n+e=34\) \(\Rightarrow2p+n=34\left(1\right)\)
Ta có: Số hạt mang điện nhiều hơn số hạt không mang điện là 10\(\Rightarrow p+e-n=10\Rightarrow2p-n=10\left(2\right)\)
Từ \(\left(1\right),\left(2\right)\Rightarrow\left\{{}\begin{matrix}p=11\\n=12\end{matrix}\right.\)
\(\Rightarrow e=p=11\)
b) Nguyên tử khối của X: \(p+n=11+12=23\left(đvC\right)\)
Vậy X là Natri, kí hiệu là Na
Đúng 3
Bình luận (0)
Bài 1. Nguyên tử X có tổng số proton, nơtron, electron là 116 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 24. Xác định X, viết cấu hình electron của X.Bài 2 a.Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là 4s24p4 . Hãy viết cấu hình electron của nguyên tử X.b.Nguyên tử của nguyên tố Y có tổng số electron ở các phân lớp p là 11. Hãy viết cấu hình electron của nguyên tử Y.
Đọc tiếp
Bài 1. Nguyên tử X có tổng số proton, nơtron, electron là 116 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 24. Xác định X, viết cấu hình electron của X.
Bài 2 a.Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là 4s24p4 . Hãy viết cấu hình electron của nguyên tử X.
b.Nguyên tử của nguyên tố Y có tổng số electron ở các phân lớp p là 11. Hãy viết cấu hình electron của nguyên tử Y.
Bài 1:
Ta có:p+e+n=116
Tức là :2p+n=116 (pt 1)
Số hạt mang điện trong ng tử là p và nên ta có p+e =2p
Số hạt không mang điện là n
Nên ta có 2p -n=24(pt2)
Từ 1,2 suy ra 2p+n=16
2p -n =24
Giải ra ta được:p=35,n=46
Số khối A=p+n =35+46=81
Ta có kí hiệu ngtu 81x35(xin lỗi mik ko ghi được)
Đúng 0
Bình luận (0)
Một nguyên tử X có 2 lớp electron, biết lớp ngoài cùng có 4 electron. Trong nguyên tử X, số hạt mang điện hơn số hạt ko mang điện 6 hạt.a)xác định số hạt proton, electron, nơtron, NTK (đvC) và kí hiệu hóa học của Xb) Vẽ sơ đồ phân bố lớp vỏ electron vủa nguyên tử X, tính khối lượng nuyên tử X theo đơn vị gamc) Biết rằng 8 nguyên tử X nặng bằng 3 nguyên tử Y; 2 nguyên tử Y nặng bằng 4 nguyên tử Z. Xác định phân tử khối của các hợp chất XY2; XZ2 và YZ3
Đọc tiếp
Một nguyên tử X có 2 lớp electron, biết lớp ngoài cùng có 4 electron. Trong nguyên tử X, số hạt mang điện hơn số hạt ko mang điện 6 hạt.
a)xác định số hạt proton, electron, nơtron, NTK (đvC) và kí hiệu hóa học của X
b) Vẽ sơ đồ phân bố lớp vỏ electron vủa nguyên tử X, tính khối lượng nuyên tử X theo đơn vị gam
c) Biết rằng 8 nguyên tử X nặng bằng 3 nguyên tử Y; 2 nguyên tử Y nặng bằng 4 nguyên tử Z. Xác định phân tử khối của các hợp chất XY2; XZ2 và YZ3
a)
X có 6 electron
=> pX = eX = 6
nX = 2pX - 6 = 6
X là Cacbon(C), có NTK = 12 (đvC)
b)

Khối lượng của 1 nguyên tử C = 1,9926.10-23 (g)
c)
\(NTK_Y=\dfrac{8.12}{3}=32\left(đvC\right)\)
PTKXY2 = 12 + 32.2 = 76 (đvC)
\(NTK_Z=\dfrac{2.32}{4}=16\left(đvC\right)\)
PTKXZ2 = 12 + 16.2 = 44 (đvC)
PTKYZ3 = 32 + 16.3 = 80 (đvC)
Đúng 8
Bình luận (2)
ta có lớp ngoài có 4 lớp => tổng số e là : 4+2=6 hạt
=> p=e=6
2p - n = 6
<=> 12 - n = 6
<=> n=6
=> X là Cacbon : C
c) ta lại có : 8X = 3Y => 48 = 3Y => Y = 16 => Y là S
có : 2Y = 4Z => 32 = 4Z = Z= 8 => Z là O
=> CTHH : XY2 : CS2 , XZ2 : CO2 , YZ3 : SO3
Đúng 3
Bình luận (0)
ta có lớp ngoài có 4 lớp => tổng số e là : 4+2=6 hạt
=> p=e=6
2p - n = 6
<=> 12 - n = 6
<=> n=6
=> X là Cacbon : C
c) ta lại có : 8X = 3Y => 48 = 3Y => Y = 16 => Y là S
có : 2Y = 4Z => 32 = 4Z = Z= 8 => Z là O đơn giản cũng hỏi
Đúng 0
Bình luận (0)
Một nguyên tử của nguyên tố A có tổng số hạt proton, nơtron và electron bằng 25, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 7.
a. Tìm số hạt proton, nơtron và electron của A.
b. Lập công thức hóa học của hợp chất tạo bởi Sắt và A. Gọi tên sản phẩm đó. Biết Sắt có hóa trị III.
a, Theo đề bài, ta có: \(\left\{{}\begin{matrix}p+e+n=25\\p+e-n=7\end{matrix}\right.\)
Mà p = e
\(\Rightarrow\left\{{}\begin{matrix}2p+n=25\\2p-n=7\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=n=8\\n=9\end{matrix}\right.\)
b, A là O
CTTQ: FexOy
Theo QT hoá trị: x.III = y.II
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
CTHH là Fe2O3
Đúng 1
Bình luận (0)
a)Theo đề bài,
P+E+N=25 mà P=E => 2P+N=25 (1)
2P-N=7 (2)
Từ (1) và (2) --> N=\(\dfrac{25-7}{2}\)=9
--> 2P=9+7=16 => P=E=16/2=8
Vậy N=9, P=E=8
b) A có 8 P --> A là Oxi
CTHH của hợp chất đó là FexOy (x,y∈N*) (Fe hóa trị III)
Theo quy tắc hóa trị:
III.x=2.y ---> x/y=2/3
--> CTHH của hợp chất là Fe2O3
Đúng 0
Bình luận (0)