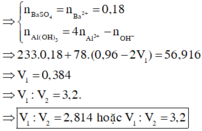Cho hai dung dịch A chứa KOH 1M và Ba(OH)2 0,5M; dung dịch B chứa AlCl3 1M và Al2(SO4)3 0,5M. Cho V1 lít dung dịch A vào V2 lít dung dịch B thu được 53,92 gam kết tủa. Cho dung dịch BaCl2 dư vào V2 lít dung dịch B thu được 69,9 gam kết tủa. Tỉ lệ V1 : V2 là
A. 4,51 hoặc 1,60.
B. 4,51 hoặc 0,99.
C. 1,60.
D. 0,99.






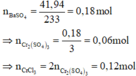
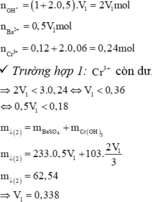
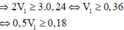
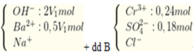
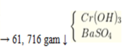
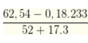 =
=