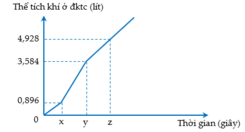
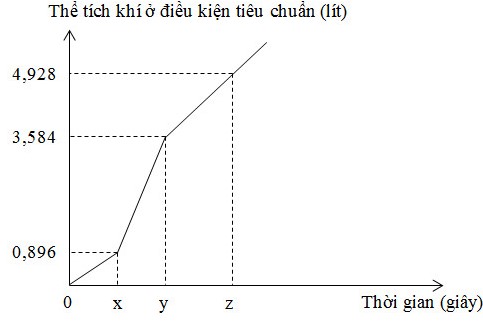
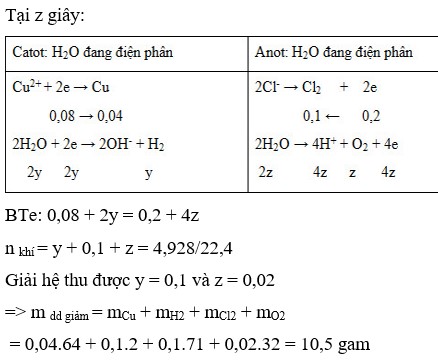
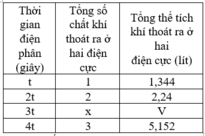
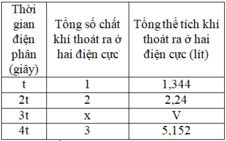
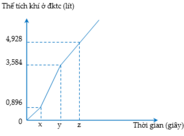
Điện phân dung dịch X chứa KCl và CuSO4 bằng dòng điện một chiều có cường độ không đổi 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị sau:
Phát biểu nào sau đây đúng?
A. Dung dịch sau điện phân có pH > 7
B. Tỉ lệ mol CuSO4 : KCl trong X là 2 : 5
C. Tại thời điểm z giây, khối lượng dung dịch giảm 10,38 gam
D. Tại thời điểm 2x giây, tổng thể tích khí thoát ra ở hai điện cực là 2,80 lít (đktc)