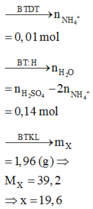SOS CÚI DƯỚICâu 1: Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO 3 và 0,16 mol H2SO4 thì thu được dung dịch chỉ chứa các muối sunfat trung hòa và 1,12 lit (đktc) hỗn hợp X gồm các oxit của nitơ có tỉ khối so với H2 là x. Giá trị của x là: A. 18,2. B. 19,6. C. 20,1. D. 19,5.Câu 2: Đốt cháy hoàn toàn 17,6 gam hợp chất hữu cơ X mạch hở, cần dùng vừa đủ 16,8 lít khí O2 (đktc), thu được CO2 và H2O theo tỷ lệ mol tương ứng là 7:6. Biết X có công thức phân tử...
Đọc tiếp
SOS CÚI DƯỚI
Câu 1: Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO 3 và 0,16 mol H2SO4 thì thu được dung dịch chỉ chứa các muối sunfat trung hòa và 1,12 lit (đktc) hỗn hợp X gồm các oxit của nitơ có tỉ khối so với H2 là x. Giá trị của x là: A. 18,2. B. 19,6. C. 20,1. D. 19,5.
Câu 2: Đốt cháy hoàn toàn 17,6 gam hợp chất hữu cơ X mạch hở, cần dùng vừa đủ 16,8 lít khí O2 (đktc), thu được CO2 và H2O theo tỷ lệ mol tương ứng là 7:6. Biết X có công thức phân tử trùng với công thức đơn giản nhất, X phản ứng hết với lượng dư dung dịch NaOH chỉ sinh ra một muối của axit no, mạch hở và một ancol có công thức phân tử C3H7OH. Số công thức cấu tạo của X toản mãn các điều kiện trên làA. 2. B. 8.C. 3. D. 4.
Câu 3: Hỗn hợp X gồm 4 chất hữu cơ đều có cùng công thức phân tử C2H8O3N2. Cho một lượng X phản ứng vừa đủ với V ml dung dịch NaOH 0,5M và đun nóng, thu được dung dịch Y thu được 29,28 gam hỗn hợp muỗi khan. Giá trị của V làA. 420B. 480C. 960D. 840
Câu 4: Hỗn hợp X gồm 2 ancol đồng đẳng kế tiếp. Đun m gam X với H2SO4 đặc, thu được H2O và hỗn hợp các chất hữu cơ Y gồm 2 ancol và 3 este. Đốt cháy hoàn toàn Y cần dùng vừa đủ 7,56 lít O2 (đktc), sinh ra 5,04 lít CO2 (đktc). Mặt khác, cho m gam X đi qua ống sử dụng CuO (dư) đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp Z gồm 2 chất hưu cơ và hơi nước. Cho Z tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 đun nóng, thu được 16,2 gam Ag. Tên thay thế của ancol có khối lượng mol phân tử lớn hơn trong X làA. butan-2-olB. propan-1-olC. butan-1-olD. protan-2-ol