hòa tan hoàn toàn 8,1g kim loại a hóa trị 3 vào h2so4, thu được 51,3 g muối sunfat. Kim loại a là

Những câu hỏi liên quan
Hòa tan hoàn toàn 20,4 g oxit kim loại A , hóa trị 3 trong 300ml DD oxit H2SO4 thu được 68,4 g muối khan . Tìm công thức oxit trên
Đặt CTHHTQ của oxit là R2O3
PTHH:
R2O3 + 3H2SO4 -> R2(SO4)3 +3H2O
Theo PTHH ta có :
nR2O3 = nR2(SO4)3
<=> 20,4 : 2R + 48 = 68,4 : 2R + 288
<=> 20,4( 2R + 288) = 68,4(2R + 48)
<=> 40,8R + 5875,2 = 136,8R + 3283,2
<=> 96R = 2592
=> R = 27(g/mol) (nhận)
=> R là kim loại nhôm ( Al = 27 )
Vậy CTHH của oxit là Al2O3
Đúng 1
Bình luận (2)
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại ABài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Đọc tiếp
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại A
Bài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
Đúng 1
Bình luận (0)
hoà tan hoàn toàn 10,2g một oxit kim loại có hoá trị 3 vào 100g dung dụng h2so4 vừa đủ sau khi phản ứng xảy ra hoàn toàn thu được 34,2 g muối sunfat a)xác định tên kim loại b) tính nồng độ % của dung dịch h2so4 c) tính thể tích dung dịch NaOH 1,5 M cần dùng để kết tủa hoàn toàn dung dịch muối trên
\(Đặt.oxit:A_2O_3\\ A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ n_{Al_2O_3}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=27\left(\dfrac{g}{mol}\right)\\ a,\Rightarrow A.là.nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=3.0,1=0,3\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,3.98}{100}.100=29,4\%\\ c,n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,1\left(mol\right)\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ n_{NaOH}=6.0,1=0,6\left(mol\right)\\ V_{ddNaOH}=\dfrac{0,6}{1,5}=0,4\left(l\right)\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 12,6 g một muối muối cacbonat của kim loại hóa trị II vào dung dịch H2SO4 loãng thu được 3,36 lít khí ở điều kiện tiêu chuẩn. Tìm CTHH của muối cacbonat
Hòa tan hoàn toàn 16 gam oxit bazo kim loại hóa trị 3 = dung dịch H2SO4 49% ( D=1.15g/ml) Sau phản ứng thu được Dung Dịch X cô cạn dd X thu được 40 gam 1 muối sunfat khan.
a) viết pthh
b) xác định kim loại
c) tính thể tích dung dịch H2So4 cần dùng
d) Tính Cm , C% của dung dịch sau phản ứng
mong mấy anh giúp em ạ !!!!!!!!!!!!
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 11,375g kim loại A hóa trị II vào dung dịch HCl thì thu được 23,8g muối khoáng. Xác định kim loại A Nhanh giúp mình nha
\(A+2HCl\rightarrow ACl_2+H_2\\ n_{HCl}=n_{Cl^-}=\dfrac{23,8-11,375}{35,5}=0,35\left(mol\right)\\ \Rightarrow n_A=\dfrac{0,35}{2}=0,175\left(mol\right)\\ \Rightarrow M_A=\dfrac{11,375}{0,175}=65\left(\dfrac{g}{mol}\right)\\ \Rightarrow A\left(II\right):K\text{ẽ}m\left(Zn=65\right)\)
Đúng 3
Bình luận (0)
\(A+2HCl\rightarrow ACl_2+H_2\\ Tacó:n_A=n_{ACl_2}\\ \Rightarrow\dfrac{11,375}{A}=\dfrac{23,8}{A+71}\\ \Rightarrow A=65\left(Zn\right)\)
Đúng 2
Bình luận (0)
Hòa tan 20g muối sunfat ngậm nước của kim loại M (chưa rõ hóa trị) vào nước rồi đem điện phân hoàn toàn, thấy ở catot tách ra 5,12 g kim loại, ở anot thoát ra 0,896 lit khí (đktc). Công thức muối đó là: A.Al2(SO4)3 B. CuSO4.5H2O C. CuSO4.3H2O D.FeSO4.7H2O
Đọc tiếp
Hòa tan 20g muối sunfat ngậm nước của kim loại M (chưa rõ hóa trị) vào nước rồi đem điện phân hoàn toàn, thấy ở catot tách ra 5,12 g kim loại, ở anot thoát ra 0,896 lit khí (đktc). Công thức muối đó là:
A.Al2(SO4)3
B. CuSO4.5H2O
C. CuSO4.3H2O
D.FeSO4.7H2O
Đáp án B:
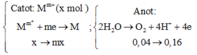
Bảo toàn electron :
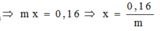
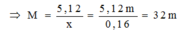
Thử lần lượt ta được M là Cu
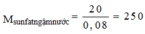
⇒ muối la CuSO4.5H2O
Đúng 0
Bình luận (0)
hòa tan hoàn toàn b (g) oxit kim loại có hóa trị II bằng 1 lượng vừa đủ dung dịch H2SO4 15,8% thu được dung dịch muối có nồng độ 22,959% . Xác định tên oxit kim loại
CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)
Đúng 3
Bình luận (0)
17, Hòa tan hoàn toàn hỗn hợp 2 kim loại trong dung dịch H2SO4 loãng thu được 0,672 lít H2(đkc). Khối lượng hỗn hợp muối sunfat khan thu được là 3,92g. Khối lượng kim loại ban đầu là?
nH2 = \(\dfrac{0,672}{22,4}=0,03mol\)
=> nH2SO4 = nH2 = 0,03mol
=> nSO42- = nH2SO4 = 0,03 mol
m kim loại = m muối - mSO42- = 3,92-0,03.96 = 1,04g
Đúng 1
Bình luận (0)





















