Cho các cân bằng hóa học sau
(1) H 2 + I 2 ⇔ 2 H I
( 2 ) 1 2 H 2 + 1 2 I 2 ⇔ H I
(3) 2 H I ⇔ H 2 + I 2
Với lần lượt các giá trị hằng số cân bằng K c b 1 , K c b 2 , K c b 2 . Nhận định nào sau đây đúng
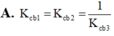
![]()
a. Cho các phương trình hóa học sau. Hãy cân bằng các phương trình phản ứng hóa học trên
và cho biết chúng thuộc loại phản ứng gì?
1.
0
3( ) ( ) 2( )
t
CaCO CaO CO r r k ⎯⎯→ + 2. PO H O H PO 2 5( ) 2 3 4 r + ⎯⎯→
3.
Al H SO Al SO H + ⎯⎯→ + 2 4 2 4 3 2 ( ) 4. Zn HCl ZnCl H + ⎯⎯→ + 2 2
b. Nhận biết các chất rắn màu trắng sau đựng trong các lọ mất nhãn: Na2O; P2O5; NaCl; CaO.
Câu 2 (2 điểm):
1. Tính độ tan của Na2SO4 ở 100C và nồng độ phần trăm của dung dịch bão hoà Na2SO4 ở nhiệt độ này. Biết
rằng ở 100C khi hoà tan 7,2g Na2SO4 vào 80g H2O thì được dung dịch bão hoà Na2SO4.
2. Cho 50ml dung dịch HNO3 40% có khối lượng riêng là 1,25g/ml. Hãy:
a. Tìm khối lượng dung dịch HNO3 40%? b. Tìm khối lượng HNO3?
c. Tìm nồng độ mol/l của dung dịch HNO3 40%?
d. Trình bày cách pha 200ml dung dịch HNO3 0,25M từ dung dịch HNO3 40% trên
Câu 1 :
b)
Cho quỳ tím ẩm vào mẫu thử
- mẫu thử hóa đỏ là P2O5
P2O5 + 3H2O $\to$ 2H3PO4
- mẫu thử hóa xanh là Na2O,CaO
Na2O + H2O $\to $ 2NaOH
CaO + H2O $\to$ Ca(OH)2
- mẫu thử không đổi màu là NaCl
Cho hai mẫu thử còn vào dung dịch H2SO4
- mẫu thử tạo kết tủa trắng là CaO
CaO + H2SO4 $\to$ CaSO4 + H2O
- mẫu thử không hiện tượng là Na2O
Câu 2 :
1)
\(S_{Na_2SO_4} = \dfrac{m_{Na_2SO_4}}{m_{H_2O}}.100 = \dfrac{7,2}{80}.100\% = 9(gam)\\ C\%_{Na_2SO_4} = \dfrac{S}{S + 100}.100\% = \dfrac{9}{100 + 9}.100\% = 8,26\%\)
cân bằng các phương trình hóa học cho các sơ đồ phản ứng sau:
Al + H2SO4 → Al2(SO4)3 + h2S + H2O
8Al + 15H2SO4 = 4Al2(SO4)3 + 3H2S + 12H2O
8Al + 15H2SO4→ 4Al2(SO4)3 + 3H2S + 12H2O
Sau khi cân bằng ta có PTHH :
8Al + 15H2SO4 → 4Al2(SO4)3 + 3H2S + 12H2O
Cho cân bằng hóa học sau: N2 (k) + 3H2 (k) →2 NH3 (k) ∆H<0. Phát biểu nào sau đây sai ?
A. Thêm một ít bột Fe(chất xúc tác) vào bình phản ứng, cân bằng chuyển dịch theo chiều thuận.
B. Giảm thể tích bình chứa, cân bằng chuyển dịch sang chiều thuận.
C. Tăng nhiệt độ, cân bằng chuyển dịch sang chiều nghịch.
D. Thêm một ít H2SO4 vào bình phản ứng, cân bằng chuyển dịch sang chiều thuận
Đáp án A
Chất xúc tác không làm chuyển dịch cân bằng mà chỉ làm tăng tốc độ phản ứng nên đáp án A sai.
=> Đáp án A
BÀI 2: Nếu ý nghĩa các công thức hóa học sau : (6đ) a/ Cao b/ H,SO, ( cho : Ca-40, H=I, S-32.0-16) Hết
H 2 S+O 2 SO 2 +H 2 O
Hoàn tất các phương trình hóa học sau bằng phương pháp thăng bằng electron; cho biết chất khử, chất oxi hóa, chất môi trường, quá trình khử, quá trình oxi hóa:
Chất khử: H2S
Chất oxi hóa : O2
Chất môi trường: không có
\(QToxh:S^{-2}+6e\rightarrow S^{+4}|\times2\\ QTkhử:\overset{0}{O_2}+4e\rightarrow2O^{2-}|\times3\\ \Rightarrow PT:2H_2S+3O_2\rightarrow2SO_2+2H_2O\)
Fe 2 O 3 +H 2 Fe+H 2 O
Hoàn tất các phương trình hóa học sau bằng phương pháp thăng bằng electron; cho biết chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa:
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
Chất oxh: Fe2O3, chất khử: H2
| QT oxh | H20 -2e-->H2+1 | x3 |
| QT khử | Fe2+3 + 6e --> 2Fe0 | x1 |
Cho phản ứng:
N 2 k + 3 H 2 k ⇆ t ∘ , x t 2 N H 3 k
∆ H < 0
Trong các yếu tố sau đây: (1) áp suất; (2) nhiệt độ; (3) nồng độ; (4) chất xúc tác, có mấy yếu tố ảnh hưởng đến cân bằng hóa học trên?
A. 1
B. 2
C. 4
D. 3
Chọn D
(1) áp suất; (2) nhiệt độ; (3) nồng độ
cân bằng các phản ứng ôxi hóa khử sau bằng phương pháp thăng bằng electron : a) FeS + HNO3 tạo thành Fe(NO3)3 + H2SO4 + NO + H2O ; b) FeCl3 + KI tạo thành FeCl2 + I2 + KCl
HD:
a)
FeS - 9e = Fe+3 + S+6
N+5 + 3e = N+2
------------------------------------
FeS + 3N+5 = Fe+3 + S+6 + 3N+2
FeS + 6HNO3 ---> Fe(NO3)3 + H2SO4 + 3NO + 2H2O
b)
Fe+3 + e = Fe+2
2I- -2e = I2
-------------------------
2Fe+3 + 2I- = 2Fe+2 + I2
2FeCl3 + 2KI ---> 2FeCl2 + I2 + 2KCl
S+HNO 3 otimes H 2 SO 4 +NO 2 +H 2 O
Hoàn tất các phương trình hóa học sau bằng phương pháp thăng bằng electron; cho biết chất khử, chất oxi hóa, chất môi trường, quá trình khử, quá trình oxi hóa:
Chất khử : S
Chất oxh: HNO3
Chất môi trường : HNO3
\(QTkhử:\overset{0}{S}\rightarrow S^{+6}+6e|\times1\\ QToxh:N^{+5}+1e\rightarrow N^{+4}|\times6\\ \Rightarrow PT:S+6HNO_3\rightarrow H_2SO_4+6NO_2+2H_2O\)
cân bằng các phản ứng ôxi hóa khử sau bằng phương pháp thăng bằng electron và cho biết chất ôxi hóa , chất khử , sự ôxi hóa , sự khử ở mỗi phản ứng : a) Mg + H2SO4 tạo thành MgSO4 + S + H2O ; b) NH3 + CuO tạo thành Cu + N2 + H2O
HD:
a)
Mg - 2e = Mg+2 (Sự oxi hóa, Mg là chất khử)
S+6 + 6e = S (Sự khử, H2SO4 là chất oxi hóa)
--------------------------
3Mg + S+6 = 3Mg+2 + S
3Mg + 4H2SO4 ---> 3MgSO4 + S + 4H2O
b)
2N-3 - 6e = N2 (Sự oxi hóa, NH3 là chất khử)
Cu+2 +2e = Cu (Sự khử, CuO là chất oxi hóa)
----------------------
2N-3 + 3Cu+2 = N2 + 3Cu
2NH3 + 3CuO ---> 3Cu + N2 + 3H2O