Cho 19,5 gam một kim loại M hóa trị n tan hết trong dung dịch HNO3 thu được 4,48 lít khí NO (ở đktc). M là kim loại
A. Mg
B. Cu
C. Fe
D. Zn
Cho 19,5 gam một kim loại M hóa trị n tan hết trong dung dịch HNO3 thu được 4,48 lít khí NO (ở đktc). Kim loại M là
A. Al
B. Mg
C. Fe
D. Zn
Cho 19,2g kim loại M tác dụng với dung dịch HNO3 loãng dư thu được 4,48 lít khí duy nhất NO(đktc). Kim loại M là:
A. Mg.
B. Cu.
C. Fe.
D. Zn.
Đáp án B
Số mol NO là 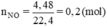
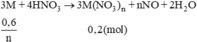
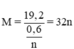 → {n = 2, M = 64)} ⇒ M là Cu
→ {n = 2, M = 64)} ⇒ M là Cu
Hòa tan hoàn toàn 6,4 gam kim loại R có hóa trị II trong dung dịch HNO 3 dư thu được 4,48 lít khí NO 2 (đktc) là sản phẩm khử duy nhất. Kim loại R là (Cho: Zn = 65, Cu = 64, Al = 27, Fe = 56)
A. Zn.
B. Cu.
C. Al.
D. Fe.
Hòa tan hết 15,2 gam hỗn hợp gồm Fe và Cu bằng dung dịch HNO3, thu được dung dịch X và 4,48 lít khí NO ( đktc). Thêm từ từ 3,96 gam kim loại Mg vào hỗn hợp X đến khi phản ứng xảy ra hoàn toàn, thu được 224 ml khí NO (đktc), dung dịch Y và m gam chất rắn không tan. Biết NO là sản phẩm khử duy nhất của N+5 trong các phản ứng. Giá trị của m là:
A. 9,6
B. 12,4
C. 15,2
D. 6,4
Hòa tan hoàn toàn 0,5 gam Fe và một kim loại hóa trị II trong dung dịch HCl thu được 1,12 lít khí H2 đktc. Kim loại hóa trị II đó là kim loại nào sau đây.
A. Mg.
B. Ca.
C. Zn.
D. Be.
Đáp án D.
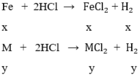
gọi x, y lần lượt là số mol của Fe và M trong hỗn hợp
số mol H2 là 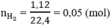
theo bài ra ta có hệ phương trình
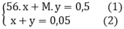
từ (2) → x= 0,05 – y
thay vào (1) ta được 56(0,05 – y) + My = 0,5
⇔ 2,8 – 56y + My = 0,5
2,3 = 56y – My
→ y = 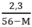
Ta có 0 < y < 0,05
y > 0 ↔ 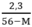 > 0 → 56 – M > 0 ⇒ M < 56
> 0 → 56 – M > 0 ⇒ M < 56
y < 0,05 ↔ 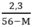 < 0,05 → 2,3 < 0,05(56 – M) → M < 10
< 0,05 → 2,3 < 0,05(56 – M) → M < 10
Trong các kim loại hóa trị II chỉ có Be thỏa mãn do đó M là Be
Hoà tan 3,06 g kim loại chưa rõ hoá trị vào dung dịch HNO3 thu được 1,904 lit khí NO (đktc)không màu, hoá nâu trong không khí. Kim loại đã dùng là
A. Zn. B. Cu. C. Fe. D. Mg.
Cho 11,2 gam hỗn hợp Cu và kim loại M tác dụng với dung dịch HCl dư thu được 3,136 lít (đktc). Cũng lượng hỗn hợp này cho tác dụng hết với dung dịch HNO3 loãng thu được 3,92 lít khí NO (đktc, sản phẩm khử duy nhất). Kim loại M là :
A. Mg B. Fe C. Mg hoặc Fe D. Mg hoặc Zn
Gọi số mol Cu, M là a, b (mol)
=> 64a + b.MM = 11,2 (1)
\(n_{NO}=\dfrac{3,92}{22,4}=0,175\left(mol\right)\)
Cu0 - 2e --> Cu+2
a--->2a
M0 - ne --> M+n
b--->bn
N+5 + 3e --> N+2
0,525<-0,175
Bảo toàn e: 2a + bn = 0,525 (2)
(1)(2) => 32bn - bMM = 5,6 (3)
\(n_{H_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\)
PTHH: 2M + 2xHCl --> 2MClx + xH2
\(\dfrac{0,28}{x}\)<---------------------0,14
=> \(\dfrac{0,28}{x}=b\) (4)
(3)(4) => MM = 32n - 20x (g/mol)
Và \(0< x\le n\)
TH1: x = n = 1 => MM = 12 (Loại)
TH2: x = n = 2 => MM = 24 (Mg)
TH3: x = n = 3 => MM = 36 (Loại)
TH4: x = 1; n = 2 => MM = 44 (Loại)
TH5: x = 1; n = 3 => MM = 76 (Loại)
TH6: x = 2; n = 3 => MM = 56 (Fe)
Vậy M có thể là Mg hoặc Fe
=> C
Hòa tan hết 17,84 gam hỗn hợp gồm 3 kim loại (Fe, Ag, Cu) dùng dư dung dịch HNO3, thu được 4,032 lít khí NO là sản phẩm khử duy nhất (ở đktc) và một dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 54,28
B. 60,27
C. 45,64
D. 51,32
Đáp án D
Ta có: mMuối = mKim loại + mNO3– = 17,84 + mNO3–
+ Mà nNO3– = 3nNO = 0,54 mol.
⇒ mMuối = 17,84 + 0,54×62 = 51,32 gam
Hòa tan hết 17,84 gam hỗn hợp gồm 3 kim loại (Fe, Ag, Cu) dùng dư dung dịch HNO3, thu được 4,032 lít khí NO là sản phẩm khử duy nhất (ở đktc) và một dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 54,28.
B. 60,27.
C. 45,64.
D. 51,32.
Ta có: mMuối = mKim loại + mNO3– = 17,84 + mNO3–
+ Mà nNO3– = 3nNO = 0,54 mol.
⇒ mMuối = 17,84 + 0,54×62 = 51,32 gam.
Đáp án D