Nung 67,2 gam hỗn hợp Fe(NO3)3, Cu(NO3)2 sau phản ứng thu được 4,48 lít khí oxi (đktc). Chất rắn sau khi nung có khối lượng là:
A. 64 g
B. 24 g
C. 34 g
D. 46 g
Hỗn hợp M gồm Al, Al2O3, Fe3O4, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam M nung nóng, sau một thời gian thu được hỗn hợp rắn G và hỗn hợp khí X có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ G trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16,75. Giá trị của m là
A. 96,25
B. 117,95
C. 139,50
D. 80,75
Nung nóng m gam hỗn hợp H gồm Cu, CU(NO3)2, Fe, Fe(NO3)2, Fe(NO3)3, thu được hỗn hợp rắn X và 8,96 lít một khí Z (đktc). Cho toàn bộ X tác dụng với dung dịch HNO3 dư, thu được 4,032 lít khí NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho lượng dư dung dịch NaOH vào Y được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 41,6 gam rắn. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 55,68
B. 58,88
C. 54,56
D. 60,00
Phần O2 sinh ra khi nung đi hết vào kim loại tạo oxit, đó là lý do ta chỉ thu được một khí Z là NO2 (0,4 mol).
Khi nung hỗn hợp T trong không khí thì sản phẩm thu được sẽ gồm các oxit “bão hòa” hóa trị (CuO, Fe2O3).
Số mol electron tối đa mà X có thể cho là: 3nNO =0,54 mol
Như vậy sẽ cần 0,54/2 = 0,27 mol O đưa vào rắn X để thu được 41,6 gam rắn gồm các oxit “bão hòa”.
→mX = mr + mO = 41,6 -0,27.16=37,28 gam
→m =mX = mNO2 = 37,28+46x0,4=55,68 gam
Chọn đáp án A
Hòa tan hoàn toàn 19,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch chứa 1,2 mol HNO3, sau khi các kim loại tan hết thu được dung dịch Y (không chứa NH4+) và V lít (ở đktc) hỗn hợp khí gồm hai khí có tỉ lệ mol 1 : 2. Cho 500 ml dung dịch KOH 1,7M vào Y thu được kết tủa D và dung dịch E. Nung D trong không khí đến khối lượng không đổi, thu được 26 gam chất rắn F. Cô cạn cẩn thận E thu được chất rắn G. Nung G đến khối lượng không đổi, thu được 69,35 gam chất rắn khan. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là:
A. 10,08.
B. 11,20.
C. 13,44.
D. 11,20.
Hòa tan hoàn toàn 19,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch chứa 1,2 mol HNO3, sau khi các kim loại tan hết thu được dung dịch Y (không chứa NH4+) và V lít (ở đktc) hỗn hợp khí gồm hai khí có tỉ lệ mol 1 : 2. Cho 500 ml dung dịch KOH 1,7M vào Y thu được kết tủa D và dung dịch E. Nung D trong không khí đến khối lượng không đổi, thu được 26 gam chất rắn F. Cô cạn cẩn thận E thu được chất rắn G. Nung G đến khối lượng không đổi, thu được 69,35 gam chất rắn khan. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
A. 10,08
B. 11,20
C. 13,44
D. 11,20
Hòa tan hoàn toàn 19,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch chứa 1,2 mol HNO3, sau khi các kim loại tan hết thu được dung dịch Y (không chứa NH4+) và V lít (ở đktc) hỗn hợp khí gồm hai khí có tỉ lệ mol 1 : 2. Cho 500 ml dung dịch KOH 1,7M vào Y thu được kết tủa D và dung dịch E. Nung D trong không khí đến khối lượng không đổi, thu được 26 gam chất rắn F. Cô cạn cẩn thận E thu được chất rắn G. Nung G đến khối lượng không đổi, thu được 69,35 gam chất rắn khan. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
A. 10,08.
B. 11,20.
C. 13,44.
D. 11,20.
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4% sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là
A. 13,56%.
B. 20,20%.
C. 40,69%.
D. 12,20%.
Hoà tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B ( gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng khống đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là:
A. 12,20%.
B. 13,56%.
C. 40,69%.
D. 20,20%.
Đáp án B
Trong T có KNO3
KN O 3 → t 0 KN O 2 + 0,5 O 2
Nếu trong T không có KOH, vậy khối lượng chất rắn thu được sau khi nhiệt phân T là khối lượng của KNO2.
mKNO2 = 0,5. 85 = 42,5 > 41,05
=> T gồm KOH dư và KNO2
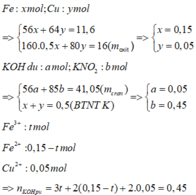

Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B ( gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là:
A. 12,20%.
B. 13,56%.
C. 40,69%
D. 20,20%.
Đáp án B
► Giả sử KOH không dư ||⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí!. ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ||⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
● Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g) || 16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16 ||⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
||⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
► nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol ||⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu
vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B ( gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là:
A. 12,20%.
B. 13,56%.
C. 40,69%.
D. 20,20%.
Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%