Cho 150 ml dung dịch NaOH 7M tác dụng với 250 ml dung dịch Al2(SO4)3 0,625M, thu được m gam kết tủa. Giá trị của m là
A. 7,8
B. 15,6
C. 10,2
D. 3,9
Cho 150 ml dung dịch NaOH 7M tác dụng với 250 ml dung dịch Al2(SO4)3 0,625M, thu được m gam kết tủa. Giá trị của m là
A. 7,8
B. 15,6
C. 10,2
D. 3,9
Cho 1,05 mol NaOH + 0,15625 mol Al2(SO4)3
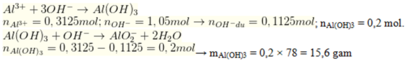
Đáp án B
Dung dịch X gồm MgSO4 và Al2(SO4)3. Cho 400 ml dung dịch X tác dụng với dung dịch NH3 dư, thu được 65,36 gam kết tủa.Mặt khác, nếu cho 200 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 151,41 gam kết tủa. Nếu thêm m gam NaOH vào 500 ml dung dịch X, thu được 70 gam kết tủa. giá trị lớn nhất của m là
A. 104.
B. 128.
C. 120.
D. 136.
Đáp án B
Gọi số mol MgSO4 và Al2(SO4)3 lần lượt là x và y (mol) có trong 200ml dung dịch.
+ 400 ml dd X + NH3 dư => kết tủa thu được là Mg(OH)2 : 2x ( mol) và Al(OH)3: 4y (mol)
=> ∑ mkết tủa = 58.2x + 78.4y = 65,36 (1)
+ 200 ml dd X + Ba(OH)2 dư => kết tủa thu được là Mg(OH)2 : x (mol) và BaSO4 : x + 3y (mol) ( Vì Al(OH)3 tan được trong dd Ba(OH)2 dư)
=> ∑ mkết tủa = 58x + (x + 3y).233 = 151,41 (2)
Từ (1) và (2) => x = 0,16 ; y = 0,15
+ 500 ml dd X ( có 0,4 mol Mg2+, 0,75 mol Al3+) + NaOH→ 70gam kết tủa => lượng NaOH lớn nhất ứng với trường hợp tạo Mg(OH)2↓ và Al(OH)3↓ sau đó kết tủa bị hòa tan 1 phần
=> nAl(OH)3 = (70 – 0,4.58)/78 = 0,6 (mol)
Mg2+ + 2OH → 2Mg(OH)2↓
0,4 → 0,8 (mol)
Al3+ + 3OH-→ Al(OH)3↓
0,75→2,25 → 0,75 (mol)
Al(OH)3+ OH- → AlO2- + 2H2O
(0,75-0,6) → 0,15 (mol)
∑ nOH-= 0,8 + 2,25 + 0,15 = 3,2 (mol) =nNaOH
=> mNaOH = 3,2.40 = 128 (g)
Cho 300 g dung dịch NaOH 8% tác dụng với 150 ml dung dịch Al2( SO4)3 1M. Sau phản ứng khối lượng kết tủa thu được là
A. 7,8 gam
B. 15,6 gam
C. 23,4 gam
D. 11,7 gam
Ta có:
\(\left\{{}\begin{matrix}n_{NaOH}=\frac{300.8\%}{40}=0,6\left(mol\right)\\n_{Al2\left(SO4\right)3}=0,15.1=0,15\left(mol\right)\end{matrix}\right.\)
\(PTHH:Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
Ban đầu:___0,15_______0,6____________
Phứng :____0,1_________0,6_________0,2_______
Sau : ______0,05________0_________0,2____________
\(\Rightarrow m_{Al\left(OH\right)3}=0,2.78=15,6\left(g\right)\)
Cho 150 ml dung dịch Ba(OH)2 1M vào 250 ml dung dịch Al2(SO4)3 x(M) thu được 42,75 gam kết tủa. Thêm tiếp 200 ml dung dịch Ba(OH)2 1M vào hỗn hợp phản ứng thì lượng kết tủa thu được là 94,2375 gam. Giá trị của x là
A. 0,15
B. 0,3
C. 0,25
D. 0,45
Chọn D.
nBa(OH)2 đầu = 0.15 => nOH- = 0.3
nAl2(SO4)3 = 0.25x => nAl3+ = 0.5x và nSO4(2-) = 0.75x
Khi cho 150ml Ba(OH)2 vào dd thu được 42.75g kết tủa
Thêm tiếp 200ml
=> m kết tủa theo lí thuyết = 350*42.75/150 = 99.75g > 94.2375g
=> Lúc đầu chưa tạo kết tủa cực đại, Al2(SO4)3 dư ; sau khi thêm Ba(OH)2 vào thì pứ tạo kết tủa
lớn nhất và sau đó Ba(OH)2 dư sẽ hòa tan thêm một phần kết tủa
+ Khi chưa thêm: (tính theo nBa(OH)2)
Ba2+ + SO42- ---> BaSO4
0.15 0.15 0.15
Al3+ + 3OH- ----> Al(OH)3
0.1 0.3 0.1
+ Khi thêm Ba(OH)2 vào: (tính theo nAl2(SO4)3)
Ba2+ + SO42- ---> BaSO4
0.75x-0.15 0.75x-0.15
Al3+ + 3OH- ---> Al(OH)3
0.5x-0.1 1.5x-0.3 0.5x-0.1
OH- dư + Al(OH)3 --->AlO2- + 2 H2O
0.4-1.5x+0.3 0.7-1.5x
Ta có:
m kết tủa lúc sau = m kết tủa ban đầu + mBaSO4 sau + mAl(OH)3 chưa tan lúc sau = 42.75 + 233*(0.75x-0.15) +
78*(0.5x-0.1-0.7+1.5x)
=> 330.75x - 54.6 = 94.2375
=> x = 0.45
Cho 150 ml dung dịch Ba(OH)2 1M vào 250 ml dung dịch Al2(SO4)3 x(M) thu được 42,75 gam kết tủa. Thêm tiếp 200 ml dung dịch Ba(OH)2 1M vào hỗn hợp phản ứng thì lượng kết tủa thu được là 94,2375 gam. Giá trị của x là
A. 0,4
B. 0,35
C. 0,45
D. 0,3
Chọn đáp án C
Chú ý :
(1). Trong bài toán này người ta không vớt kết tủa lần đầu ra mà cứ để yên rồi đổ thêm Ba(OH)2 vào.
(2). Để mò ra đáp án nhanh bài toán này các bạn cần tư duy nhanh xem lượng kết tủa ở lần 1 và 2 có bị tan phần nào không.Điều này khá đơn giản.
+Nhìn nhanh qua đáp án cũng khẳng định được ở lần 1 muối sunfat có dư.
+Khi đổ thêm Ba(OH)2 dễ thấy Al(OH)3 bị tan vì khi x = 0,45 vẫn bị tan
Khi đó ta có
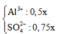
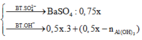
![]()
![]()
Vậy
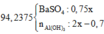
![]()
![]()
Bài này các bạn cũng có thể dùng thủ đoạn truyền thống “thử đáp án”
Trộn 250 ml dung dịch AlCl3 xM với 200 ml dung dịch NaOH yM thu được 3,9 gam kết tủa. Nếu trộn 250 ml dung dịch AlCl3 xM với 400 ml dung dịch NaOH yM thì cũng thu được 3,9 gam kết tủa. Giá trị của x là
A. 0,25.
B. 0,35.
C. 0,3.
D. 0,4.
1. Cho 3,42 gam Al2(SO4)3 tác dụng với 200 ml dung dịch NaOH, sau phản ứng thu được 0,78 gam kết tủa. Nồng độ mol nhỏ nhất của dung dịch NaOH đã dùng là
2. Rót V ml dung dịch NaOH 2M vào cốc đựng 300 ml dung dịch Al2(SO4)3 0,25M thu được kết tủa. Lọc kết tủa rồi nung đến khối lượng ko đổi được 5,1 gam chất rắn. Giá trị lớn nhất của V là
3. Cho 150 ml dung dịch KOH 1,2M tác dụng với 100 ml dung dịch AlCl3 nồng độ x mol/l, thu được dung dịch Y và 4,68 gam kết tủa. Loại bỏ kết tủa, thêm tiếp 175 ml dung dịch KOH 1,2M vào Y, thu được 2,34 gam kết tủa. Giá trị của x là:
Làm 3 bài trên nhưng không dùng phương trình ion, dùng pthh với ạ
1) \(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
PTHH: \(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,03<----------------------0,01
=> nNaOH min = 0,03 (mol)
=> \(C_{M\left(NaOH\right)}=\dfrac{0,03}{0,2}=0,15M\)
2) \(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0,3.0,25=0,075\left(mol\right)\)
PTHH: \(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,45<------0,075-------------------------->0,15
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,05<----0,05
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
0,1<-------0,05
=> nNaOH max = 0,5 (mol)
=> \(V_{dd}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
3)
\(n_{KOH\left(1\right)}=0,15.1,2=0,18\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(1\right)}=\dfrac{4,68}{78}=0,06\left(mol\right)\)
\(n_{AlCl_3}=0,1.x\left(mol\right)\)
Do khi cho KOH tác dụng với dd Y xuất hiện kết tủa
=> Trong Y chứa AlCl3 dư
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
0,18---->0,06----------------->0,06
\(n_{KOH\left(2\right)}=0,175.1,2=0,21\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(2\right)}=\dfrac{2,34}{78}=0,03\left(mol\right)\)
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
(0,3x-0,18)<--(0,1x-0,06)------->(0,1x-0,06)
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
(0,1x-0,09)<-(0,1x-0,09)
=> \(\left(0,3x-0,18\right)+\left(0,1x-0,09\right)=0,21\)
=> x = 1,2
Cho 300 ml dung dịch NaOH 0,1M phản ứng với 100 ml dung dịch Al2(SO4)3 0,1 M. Sau phản ứng hoàn toàn thu được a gam kết tủa. Giá trị của a là
A. 2,34
B. 1,56
C. 1,17
D. 0,78
Giải thích:
nOH = 0,03 mol và nAl3+ = 0,02mol
Khi cho dung dịch NaOH vào thì
Al3+ + 3OH- → Al(OH)3
Ban đầu : 0,02 mol 0,03 mol
Sau PƯ 0,01 0 0,01 mol
→ mAl(OH)3 = 0,78 g
Đáp án D
Hoà tan hết m gam Al2(SO4)3 vào nước được dd A. Cho 300 ml dung dịch NaOH 1M vào A, thu được a gam kết tủa. Mặc khác, nếu cho 400 ml dung dịch NaOH 1M vào A, cũng thu được a gam kết tủa. Giá trị của m là
A. 21.375
B. 42.75
C. 17.1
D. 22.8