Trộn 300ml dung dịch HCl 0,05M với 200ml dung dịch Ba(OH)2 a mol/l thu được 500ml dung dịch có pH =12. Giá trị của a là:
A. 0,05M
B. 0,055M
C. 0,075M
D.0,5M
Trộn 300ml dung dịch HCl 0,05M với 200ml dung dịch Ba(OH)2 nồng độ a mol/l thu được 500ml dung dịch có pH = x. Cô cạn dung dịch sau phản ứng thu được 1,9875 gam chất rắn. Giá trị của a và x lần lượt là
![]()
![]()
![]()
![]()
Trộn 300ml dung dịch HCl 0,05M với 200ml dung dịch Ba(OH)2 nồng độ a mol/l thu được 500ml dung dịch có pH = x. Cô cạn dung dịch sau phản ứng thu được 1,9875 gam chất rắn. Giá trị của a và x lần lượt là
A. 2 , 5 . 10 - 3 M ; 13
B. 2 , 5 . 10 - 3 M ; 12
C. 0 , 05 M ; 13
D. 0 , 05 M ; 12
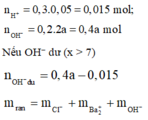
→ 0,015.35,5 + 0,2a.137 + 17(0,4a - 0,015) = 1,9875
→ a = 0,05 M

Đáp án D
Trộn 200ml dung dịch HCl 0,1M và H2SO4 0,05M với 300ml dung dịch Ba(OH)2 aM thu được m gam kết tủa và 500ml dung dịch có pH =13. Vậy a và m có giá trị lần lượt là:
A. 0,15M ; 2,33g
B. 0,15M ; 10,485g
C. 0,3M ; 4,66g
D. 0,2M ; 6,99g
Đáp án A
nH+ = 0,2.0,1 + 0,2.2.0,05 = 0,04
Sau phản ứng thu được 500ml dung dịch có pH =13 ⇒ nOH- lúc sau = 0,05
⇒ nBa =1/2 nOH- ban đầu = 0,045 ⇒ a = 0,045 ÷ 0,3 = 0,15
nH2SO4 = 0,2.0,05 = 0,01< n Ba = 0,045 ⇒ n↓ = n H2SO4 = 0,01 mol
⇒ m↓ = 2,33g
Đáp án A.
Trộn 200ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M với 300ml dung dịch Ba(OH)2 a M thu được m (g) kết tủa và 500ml dung dịch ph=13. Tìm a , m .
a=0,12
m=2,33g
Trộn 200mL dung dịch HCl xM với 300mL dung dịch Ba(OH)2 0,05M được dung dịch mới có độ pH=1. Tính x
Em cần gấp ạ.
\(n_{H^{^{ }+}}=0,2x\left(mol\right);n_{OH^-}=0,3.0,05.2=0,03mol\\ pH=1\Rightarrow H^+:dư\left(0,2x-0,03\left(mol\right)\right)\\ pH=-log\left[H^+\right]\Rightarrow1=-log\left(0,2x-0,03\right)\\ x=0,65\)
trộn 300ml dung dịch (HCL,H2S04) có PH=1 và tỉ lệ mol giữa axit HCL và H2S04 là 1:2 vào 400ml dung dịch (NaOH 0,05M,Ba(OH)2 a mol/l) thu được dung dịch X có PH=13
a) TÍNH a b)cô cạn dung dịch x thu dc bn gam rắn khan
Cho 200ml dung dịch chứa đồng thời HCl 0,075M và H2SO4 0,025M. Trộn 300ml dung dịch X với 300ml dung dịch Ba(OH)2 aM thu được m gam kết tủa và dung dịch thu được có pH=12
a.Tính nồng độ mol của ion trong dung dịch X
b.Tính a
Bài 2: Trộn lẫn 300ml dung dịch HCl 0,2M với 200ml dung dịch H2SO4 0,05M thu được dung dịch X. Tính pH của dung dịch X.
Bài 3:Trộn lẫn 150 ml dung dịch NaOH 2M với 200 ml dung dịch H2SO4 1M, thu được dung dịch X. Tính giá trị pH dung dịch X.
Bài 4: Cho 200 ml dung dịch NaHCO3 1M tác dụng với dung dịch Ba(OH)2 dư thu được m gam kết tủa trắng. Tìm giá trị của m.
Bài 5: Hòa tan hết 9,9 gam Zn(OH)2 cần vừa đủ V ml dung dịch HCl 2M. Tìm giá trị của V.
Trộn 200ml dung dịch Ba(OH)2 aM với 300ml dung dịch H2SO4 có pH=1 thu được m gam kết tủa và 500ml dung dịch có pH=2. Giá trị của a và m lần lượt là:
A. 0,125M và 5,825 gam
B. 0,1 M và 4,66 gam
C. 0,0625M và 2,9125 gam
D. 0,125M và 3,495 gam
Đáp án C
nBa(OH)2 = 0,2.a mol; nOH-= 0,4a mol
dung dịch H2SO4 có pH = 1 nên [H+] = 10-1 M
→nH+ = [H+].Vdd = 0,3.10-1 = 0,03 mol, nSO4(2-) = 0,015 mol
H2SO4→ 2H++ SO42-
0,03 →0,015 mol
Ba(OH)2→ Ba2++ 2OH-
0,2a→ 0,2a 0,4a
H+ + OH- → H2O
0,4a 0,4a
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,03-0,4a
[H+] dư = nH+ dư/ Vdd = (0,03-0,4a)/0,5 = 10-2 suy ra a = 0,0625 M
Ba2++ SO42- → BaSO4
0,0125 0,015 0,0125 mol
mBaSO4 = 2,9125 gam