Cho 4,8g S tan hết trong 100g HNO3 63% được NO2 là sản phẩm khử duy nhất và dung dịch X . Dung dịch X có thể hoà tan hết tối đa bao nhiêu gam Cu biết sản phẩm khử của N+5 là N+2 :
A. 9,6g
B. 2,4g
C. 12,8g
D. 6,4g
Cho 0,64 gam S tan hoàn toàn trong 150 gam dung dịch HNO3 63%, đun nóng thu được khí NO2 (sản phẩm khử duy nhất) và dung dịch X. Hãy cho biết dung dịch X có thể hoà tan tối đa bao nhiêu gam Cu (Biết sản phẩm khử duy nhất là NO)?
A. 33,12 gam.
B. 24,00 gam.
C. 34,08 gam.
D. 132,48 gam.
Cho 0,64 gam S tan hoàn toàn trong 150 gam dung dịch HNO3 60%, đun nóng thu được khí NO2 (sản phẩm khử duy nhất) và dung dịch X. Hãy cho biết dung dịch X có thể hòa tan tối đa bao nhiêu gam Cu (sản phẩm khử duy nhất là NO):
A. 33,12 gam
B. 24,00 gam
C. 34,08 gam
D. 132,38 gam
Hoà tan hết 12,8 gam hỗn hợp X gồm Cu2S và FeS2 trong dung dịch có chứa a mol HNO3 thu được 31,36 lít khí NO2 (ở đktc và là sản phẩm duy nhất của sự khử N+5) và dung dịch Y. Biết Y phản ứng tối đa với 4,48 gam Cu giải phóng khí NO. Tính a
A. 1,42 mol.
B. 1,44 mol.
C. 1,92 mol.
D. 1,8 mol.
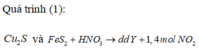
Vì thế Cu và Y vẫn có NO thoát ra
→ chứng tỏ H N O 3 dư
→ chứng tỏ phản úng oxi hóa – khử (1) xảy ra hoàn toàn.
→ khối lượng 12,8 kết hợp bảo toàn electron:
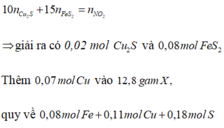
Phản ứng
a m o l H N O 3 → m u ố i F e 2 + ; C u 2 + ; S O 4 2 - ; N O 3 - + 1 , 4 m o l N O 2 + ? m o l N O

Đáp án là B
Hoà tan hết 12,8 gam hỗn hợp X gồm Cu2S và FeS2 trong dung dịch có chứa a mol HNO3 thu được 31,36 lít khí NO2 (ở đktc và là sản phẩm duy nhất của sự khử N+5) và dung dịch Y. Biết Y phản ứng tối đa với 4,48 gam Cu giải phóng khí NO.Tính a?
A. 1,8 mol
B. 1,44 mol
C. 1,92 mol
D. 1,42 mol
Đáp án B
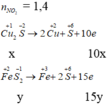
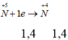
Ta có hpt: 160x + 120y = 12,8
10x + 15y = 1,4
=> x= 0,02, y= 0,08
DD Y: CuSO4 =2x = 0,04 Fe2(SO4)3 =0,5y = 0,04
H2SO4 = x+2y – 2x –3.0,5y = 0,02 ( bảo toàn nguyên tố S)
HNO3 dư
nCu= 0,07
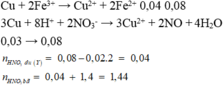
Hoà tan hết 12,8 gam hỗn hợp X gồm Cu2S và FeS2 trong dung dịch có chứa a mol HNO3 thu được 31,36 lít khí NO2 (ở đktc và là sản phẩm duy nhất của sự khử N+5) và dung dịch Y. Biết Y phản ứng tối đa với 4,48 gam Cu giải phóng khí NO. Tính a ?
A. 1,8 mol
B. 1,44 mol
C. 1,92 mol
D. 1,42 mol
Hoà tan hết 12,8 gam hỗn hợp X gồm Cu2S và FeS2 trong dung dịch có chứa a mol HNO3, thu được 31,36 lít khí NO2 (ở đktc và là sản phẩm duy nhất của sự khử N+5) và dung dịch Y. Biết Y phản ứng tối đa với 4,48 gam Cu giải phóng khí NO. Tính a ?
A. 1,8 mol.
B. 1,44 mol
C. 1,92 mol
D. 1,42 mol
Đáp án B
Theo giả thiết và áp dụng bảo toàn electron cho phản ứng của X với HNO3, ta có :
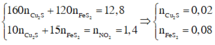
Dung dịch Y gồm Fe3+, Cu2+, SO 4 2 - , NO 3 - , H+. Khi cho Cu (tối đa) vào Y, Cu bị oxi hóa bởi (H+, NO 3 - ) và Fe3+. Vậy bản chất của bài toán là: Hỗn hợp Cu2S, FeS2 và Cu tác dụng với dung dịch HNO3, giải phóng hỗn hợp khí NO, NO2 và tạo ra dung dịch Z. Dung dịch Z có các ion Fe2+, Cu2+, SO 4 2 - , ion còn lại là H+ hoặc NO 3 - . Vì
![]()
nên ion còn lại trong dung dịch Z là ion âm để cân bằng điện tích, đó là ion NO 3 - .
Áp dụng bảo toàn electron và bảo toàn điện tích trong dung dịch Z và bảo toàn nguyên tố N, ta có :
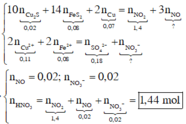
Hoà tan hoàn toàn 0,1 mol FeS2 trong 200 ml dung dịch HNO3 4M, sản phẩm thu được gồm dung dịch X và một chất khí thoát ra. Dung dịch X có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Giá trị của m là
A. 12,8.
B. 6,4.
C. 9,6.
D. 3,2.
Hoà tan 0.1 mol fes2 trong 200ml dd hno3 4M ,sản phẩm thu đc gồm dung dịch x và 1 chất khí thoát ra. Dung dịch x có thể hoà tan tối đa m gam cu . Biết trong quá trình trên ,sản phẩm khử duy nhất của n+5 là no. Tính giá trị m
Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 phản ứng hết với dung dịch HNO3 loãng, dư thu được 1,344 lít khí NO (ở đktc) và dung dịch X. Dung dịch X có thể hoà tan được tối đa 12,88 gam Fe. Biết khí NO là sản phẩm khử duy nhất của N+5. Số mol của HNO3 có trong dung dịch ban đầu là
A. 1,04 mol.
B. 0,64 mol.
C. 0,94 mol.
D. 0,88 mol