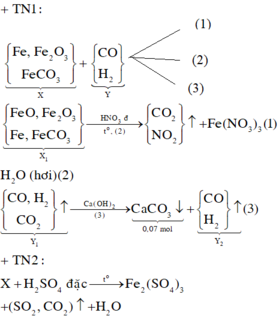
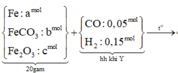
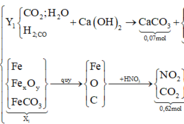
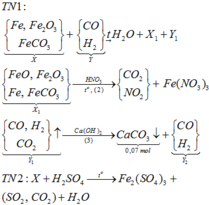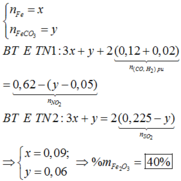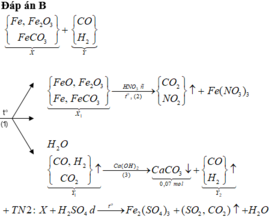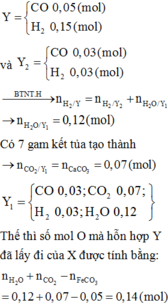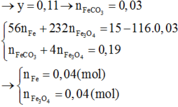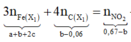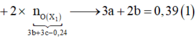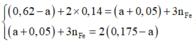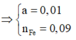Cho 16,2 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 vào ống sứ nung nóng và dẫn từ từ 0,2 mol hỗn hợp khí Y gồm CO và H2 qua ống, trong đó tỉ khối của Y so với H2 la 4,25. Khí thoát ra được hấp thụ vào dung dịch Ca(OH)2 dư, thấy có 7 gam kết tủa và còn 0,06 mol khí Z, tỉ khối của Z so với H2 là 7,5. Thành phần phần trăm số mol Fe2O3 trong X là (biết các phản ứng xảy ra hoàn toàn)
A. 16,67
B. 27,77
C. 35,80
D. 55,56