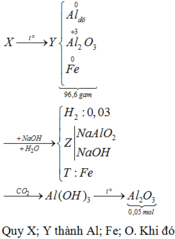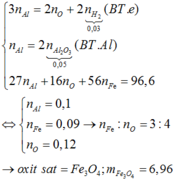Nung 18g rắn nhôm hidroxit được 10,2g rắn nhôm oxit (2 nguyên tố Al, O) và 5,4g H2O.
a) Lập PTHH
b) Tính khối lượng chất rắn bị nung
c) Tính khối lượng chất rắn sau phản ứng

Những câu hỏi liên quan
Cho 27,2g dd CuCl2 td với 20g NaOH. Lọc hỗn hợp chất sau p/ ứng được kết tủa và nước lọc. Nung kết tủa đến khối lượng không đổi
a) Viết PTHH
b) Tính KL chất rắn thu được sau khi nung
c) Tính khối lượng các chất tan có trong nước lọc
\(n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)
a) \(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\left(1\right)\)
\(Cu\left(OH\right)_2\xrightarrow[t^o]{}CuO+H_2O\left(2\right)\)
b) \(Pt\left(1\right):n_{Cu\left(OH\right)2}=\dfrac{1}{2}n_{NaOH}=0,25\left(mol\right)\)
\(Pt\left(2\right):n_{Cu\left(OH\right)2}=n_{CuO}=0,25\left(mol\right)\Rightarrow m_{Cu}=0,25.64=16\left(g\right)\)
c) Pt(1) : \(n_{NaOH}=n_{NaCl}=0,5\left(mol\right)\Rightarrow m_{NaCl}=0,5.58,5=29,25\left(g\right)\)
Đúng 3
Bình luận (0)
Đốt cháy hỗn hợp gồm có 5,4g bột nhôm và 4,8g bột Fe 2 O 3 để thực hiện phản ứng nhiệt nhôm. Sau phản ứng thu được hỗn hợp chất rắn A. Khối lượng A thu được là bao nhiêu?
A. 6,2g
B. 6,42g
C. 10,2g
D. 12,8g
Nung 500g đá vôi chứa 80% CaCO3 còn lại các Oxit nhôm, sắt (III) oxit và silic oxit sau 1 t.gian thu đc chất rắn X và khí CO2
a) tính khối lượng chất rắn X biết hiệu suất p.ư phân huỷ CaCO3 là 70%
b) tính % khối lượng CaCO3 trong X
Đốt cháy hoàn toàn 4,44g hỗn hợp Al và Fe trong khí oxi. Sau phản ứng kết thúc thu được chất rắn A. Cho dòng khí H2 dư đi qua A nung nóng cho tới khi các phản ứng xảy ra hoàn toàn thu được 5,4g chất rắn B. Tính khối lượng mỗi kim loại có trong hỗn hợp ban đầu.
Gọi $n_{Al}= a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 4,44(1)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
B gồm : $Al_2O_3, Fe$
$n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,5a(mol)$
Suy ra: $0,5a.102 + 56b = 5,4(2)$
Từ (1)(2) suy ra a = 0,04 ; b = 0,06
$m_{Al} = 0,04.27 =1,08\ gam$
$m_{Fe} = 0,06.56 = 3,36\ gam$
Đúng 3
Bình luận (0)
Cho 5,4 gam bột Nhôm tác dụng với dung dịch HCl dư.
a.Tính khối lượng muối Nhôm clorua (AlCl3) thu được sau phản ứng?
b.Lượng khí Hidro thu được ở trên cho qua bình đựng 32g CuO nung nóng thu được m gam chất rắn. Tính % khối lượng các chất trong m?
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.2.........................0.2.......0.3\)
\(m_{AlCl_3}=0.2\cdot133.5=26.7\left(g\right)\)
\(n_{CuO}=\dfrac{32}{160}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(1..........1\)
\(0.2........0.3\)
\(LTL:\dfrac{0.2}{1}< \dfrac{0.3}{1}\Rightarrow H_2dư\)
\(n_{Cu}=0.2\left(mol\right)\)
\(m_{Cu}=0.2\cdot64=12.8\left(g\right)\)
Em xem lại đề vì chất rắn chỉ có Cu không có CuO nhé !
Đúng 1
Bình luận (0)
Thực hiện phản ứng nhiệt nhôm (trong điều kiện không có không khí, hiệu suất 100%) với 9,66 gam hỗn hợp X gồm Al và một oxit sắt, thu được hỗn hợp rắn Y. Hòa tan Y bằng dung dịch NaOH dư, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Z, chất không tan T và 0,03 mol khí. Sục khí CO2 dư vào dung dịch Z, lọc lấy kết tủa nung đến khối lượng không đổi thu được 5,1 gam một chất rắn. Công thức oxit sắt và khối lượng của nó trong hỗn hợp X là A. Fe3O4 và 2,76 gam B. Fe3O4 và 6,96 gam C. FeO và...
Đọc tiếp
Thực hiện phản ứng nhiệt nhôm (trong điều kiện không có không khí, hiệu suất 100%) với 9,66 gam hỗn hợp X gồm Al và một oxit sắt, thu được hỗn hợp rắn Y. Hòa tan Y bằng dung dịch NaOH dư, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Z, chất không tan T và 0,03 mol khí. Sục khí CO2 dư vào dung dịch Z, lọc lấy kết tủa nung đến khối lượng không đổi thu được 5,1 gam một chất rắn. Công thức oxit sắt và khối lượng của nó trong hỗn hợp X là
A. Fe3O4 và 2,76 gam
B. Fe3O4 và 6,96 gam
C. FeO và 7,20 gam
D. Fe2O3 và 8,00 gam
Dẫn toàn bộ 3,36 lít khí hiđro đi qua 44,6 gam chì (II) oxit PbO nung nóng thu được chất rắn D và nước.
Tính khối lượng chất rắn thu được sau phản ứng.
\(n_{PbO}=\dfrac{44,6}{223}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: PbO + H2 --to--> Pb + H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) => PbO dư, H2 hết
PTHH: PbO + H2 --to--> Pb + H2O
0,15<-0,15---->0,15
=> mrắn sau pư = (0,2-0,15).223 + 0,15.207 = 42,2 (g)
Đúng 3
Bình luận (0)
H2+PbO-to>Pb+H2O
0,15---0,15----0,15
n H2=\(\dfrac{3,36}{22,4}\)=0,15 mol
n PbO=\(\dfrac{44,6}{233}\)=0,2 mol
=>PbO dư
=>m Pb=0,15.207=31,05g
=>m PbO dư=0,05.233=11,65g
Đúng 2
Bình luận (0)
Dẫn toàn bộ 3,36 lít khí hiđro đi qua 44,6 gam chì (II) oxit PbO nung nóng thu được chất rắn D và nước.
Tính khối lượng chất rắn thu được sau phản ứng.
\(n_{PbO}=\dfrac{44,6}{223}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: PbO + H2 --to--> Pb + H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) => PbO dư, H2 hết
PTHH: PbO + H2 --to--> Pb + H2O
0,15<-0,15----->0,15
=> mrắn sau pư = 44,6 - 0,15.223 + 0,15.207 = 42,2 (g)
Đúng 2
Bình luận (0)