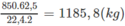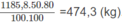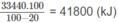Một loại khí thiên nhiên có thành phần về thể tích như sau:
85% C H 4 ; 10% C 2 H 6 ; 3% N 2 ; 2% C O 2 .
1. Người ta chuyển metan trong 1000 m 3 (đktc) khí thiên nhiên đó thành axetilen (hiệu suất 50%) rồi thành vinyl clorua (hiệu suất 80%). Viết phương trình hoá học của các phản ứng và tính khối lượng vinyl clorua thu được.
2. Người ta đốt cháy hoàn toàn khí thiên nhiên đó để đun nóng 100 lít nước từ 20 ° C lên 100 ° C . Tính thể tích khí thiên nhiên (đktc) cần đốt, biết rằng nhiệt lượng toả ra khi đốt cháy 1 mol CH4 và 1 mol C 2 H 6 lần lượt là 880 kJ và 1560 kJ ; để làm cho lml nước tăng thêm 1 ° cần 4,18 J và khi đốt khí thiên nhiên, 20% nhiệt lượng toả ra môi trường không khí.