Một bình kín chứa 1 moi khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C. Thể tích của bình xấp xỉ bằng bao nhiêu?
A. 2,5ℓ
B. 2,8 ℓ
C. 25 ℓ
D. 27,7 ℓ
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27°C. Nung bình đến khi áp suất khí là 5. 10 5 N/m:. Nhiệt độ khí bây giở là?
A. 127 ° C
B. 60 ° C
C. 135 ° C
D. 1227 ° C
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C
Nung bình đến khi áp suất khí là 5 . 10 5 N / m 2 .Nhiệt độ khí bây giờ là?
A. 127 ° C
B. 60 ° C
C. 135 ° C
D. 1227 ° C
Đáp án D.
Ta có: p 1 T 1 = p 2 T 2 ⇒ T 2 = p 2 p 1 . T 1 = 1500 K = 1227 0 C
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C
Thể tích của bình xấp xỉ bằng bao nhiêu?
A. 2,5l
B. 2,8 l
C. 25 l
D. 27,7 l
Đáp án C.
Ta có: p V = m μ R T ⇒ V = ν R T p 1 = 25 l
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C. Khi đó van điều áp mở ra và 1 lượng khí thoát ra ngoài, nhiệt độ vẫn giữ không đổi. Sau đó áp suất giảm còn 4. 10 4 N / m 2 lượng khí đã thoát ra là bao nhiêu?
A. 0,8 mol
B. 0,2mol
C. 0,4 mol
D. 0,1 mol
Chọn đáp án B
? Lời giải:
+ Do V, T không đổi nên ta có:
v 3 = p 3 p 2 . v 1 = 0 , 8 mol
khí thoát ra 0,2 mol.
Một bình kín chứa 1 mol khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C
Khi đó van điều áp mở ra và 1 lượng khí thoát ra ngoài , nhiệt độ vẫn giữ không đổi. Sau đó áp suất giảm còn 4 . 10 4 N / m 2 lượng khí đã thoát ra là bao nhiêu?
A. 0,8 mol
B. 0,2mol
C. 0,4 mol
D. 0,1 mol
Một bình kín chứa một lượng khí Nito xác định ở áp suất 105 N/m , nhiệt độ 27 độ C . Nung bình đến khi áp suất khí là 5.105 N/m2 . Nhiệt độ khí sau khi nung nóng là
Trạng thái 1: \(\left\{{}\begin{matrix}p_1=10^5Pa\\T_1=27^oC=300K\end{matrix}\right.\)
Trạng thái 2: \(\left\{{}\begin{matrix}p_2=5\cdot10^5Pa\\T_2=???\end{matrix}\right.\)
Quá trình đẳng tích:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow\dfrac{10^5}{300}=\dfrac{5\cdot10^5}{T_2}\)
\(\Rightarrow T_2=1500K=1227^oC\)
Trong một bình kín dung tích 10,0 lít chứa 21,0 g nitơ. Tính áp suất của khí trong bình, biết nhiệt độ của khí bằng 25 ° C .
Cần áp dụng phương trình trạng thái khí pV = nRT, trong đó p là áp suất của khí trong bình kín (atm) ; V là thể tích của khí (lít), n là số mol khí trong thể tích V ; T là nhiệt độ tuyệt đối (K) với T = t( ° C ) + 273 ; R là hằng số lý tưởng, với trị số
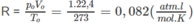
Số mol khí
N
2
: 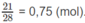
Áp suất của khí N 2 :
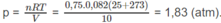
Một bình chứa 14 g khí nitơ ở nhiệt độ 27 ° C và áp suất 1 atm. Sau khi hơ nóng, áp suất trong bình chứa khí tăng lên tới 5 at. Hãy tính nhiệt lượng cần cung cấp cho khí nitơ và độ tăng nội năng của khí
Biết nhiệt dung riêng của nitơ trong quá trình nung nóng đẳng nhiệt là c V = 742 J/(kg.K). Coi sự nở vì nhiệt của bình là không đáng kể.
Do bình không dãn nở vì nhiệt, nên công do khí sinh ra : A' = p ∆ V = 0. Theo nguyên lí I, ta có :
∆ U = Q (1)
Nhiệt lượng do khí nhận được : Q = m c V ( T 2 - T 1 ) (2)
Mặt khác, do quá trình là đẳng tích nên :
![]()
Từ (2) tính được : Q = 15,58. 10 3 J.
Từ (1) suy ra: ∆ U = 15,58. 10 3 J.
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp N H 3 , lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là
A. 10 atm.
B. 8 atm.
C. 9 atm.
D. 8,5 atm.