Những câu trong bài tập này coi là tiếp theo của bài tập 17.12*. Tính khối lượng khí clo để tác dụng vừa đủ với 39g kim loại kali.

Những câu hỏi liên quan
Những câu trong bài tập này coi là tiếp theo của bài tập 17.12*. Từ khối lượng kim loại cho biết và khối lượng khí clo tính được trong câu b), tính khối lượng kali clorua thu được theo hai cách.
Cách 1: Tính theo định luật bảo toàn khối lượng:
m K C l = m K + m C l 2 = 39 + 35,5 = 74,5g
Cách 2: Tính theo phương trình hóa học:
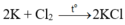
Cứ 6 , 02 . 10 23 nguyên tử K tác dụng với 3 , 01 . 10 23 phân tử Cl2 tạo ra 6 , 02 . 10 23 phân tử KCl. Vậy khối lượng của KCl trong 6 , 02 . 10 23 sẽ bằng 74,5g. (theo câu a)
Đúng 0
Bình luận (0)
Những câu trong bài tập này coi là tiếp theo của bài tập 17.12*.Tính khối lượng bằng gam của: -
6
,
02
.
10
23
nguyên tử K -
6
,
02
.
10
23
nguyên tử
C
l
2
-
6
,
02
.
10
23
phân tử KCl
Đọc tiếp
Những câu trong bài tập này coi là tiếp theo của bài tập 17.12*.
Tính khối lượng bằng gam của:
- 6 , 02 . 10 23 nguyên tử K
- 6 , 02 . 10 23 nguyên tử C l 2
- 6 , 02 . 10 23 phân tử KCl
Khối lượng tính bằng gam của:
6 , 02 . 10 23 nguyên tử K: 6 , 02 . 10 23 x 39. 1 , 66 . 10 - 24 ≈ 39(g)
6 , 02 . 10 23 nguyên tử C l 2 : 6 , 02 . 10 23 x 71. 1 , 66 . 10 - 24 ≈ 71(g)
6 , 02 . 10 23 phân tử KCl: 6 , 02 . 10 23 x 74,5. 1 , 66 . 10 - 24 ≈ 74,5(g)
Đúng 0
Bình luận (0)
Bài 4: cho 19,15g hỗn hợp X gồm 2 muối clorua của 2 kim loại kiềm A và B (A và B ở 2 chu kì liên tiếp) tác dụng vừa đủ với 300g dung dịchAgNO3AgNO3, sau phản ứng thu được 43,05g kết tủa và dung dịch Ca) Xác định tên và khối lượng các muối clorgua trong hôn hợp Xb) Xác định noongf độ phần trăm các muối trong dung dịch Cc) Hãy viết PTHH để chứng minh A và B là những kim loại mạnhBài 5: Cho 4,8g một kim loại thuộc nhóm IIA tác dụng vừa đủ với dung dịch H2SO4H2SO4 1M thu được 4,48 lít khí ở đktca) x...
Đọc tiếp
Bài 4: cho 19,15g hỗn hợp X gồm 2 muối clorua của 2 kim loại kiềm A và B (A và B ở 2 chu kì liên tiếp) tác dụng vừa đủ với 300g dung dịchAgNO3AgNO3, sau phản ứng thu được 43,05g kết tủa và dung dịch C
a) Xác định tên và khối lượng các muối clorgua trong hôn hợp X
b) Xác định noongf độ phần trăm các muối trong dung dịch C
c) Hãy viết PTHH để chứng minh A và B là những kim loại mạnh
Bài 5: Cho 4,8g một kim loại thuộc nhóm IIA tác dụng vừa đủ với dung dịch H2SO4H2SO4 1M thu được 4,48 lít khí ở đktc
a) xác định tên kim loại
b) tính thể tích dung dịch H2SO4H2SO4đã dùng
c) Tính khối lượng muối và nồng độ mol của dung dịch thu được ( coi thể tích dung dịch thay đổi ko đáng kể sau phản ứng)
Bài 6: Cho 28,8g hỗng hợp hai kim loại thuộc nhóm IIA và nằm ở chu kì 2 kế tiếp nhau trong bảng tuần hoàn tác dụng hết với 400ml dung dịch HCl vừa đủ tạo 17,92 lít khi (đktc) và dung dịch B
a) Xác định hai kim loại và tính thành phần % về khối lượng mỗi kim loại
b) Tính nồng độ mol/l của dung dịch HCl
Một bếp lửa chờn vờn sương sớm
Một bếp lửa ấp iu nồng đượm
Cháu thương bà biết mấy nắng mưa
Hình ảnh “bếp lửa” trong màn sương sớm đã được khắc họa giản dị nhưng rõ nét và sống động qua ba câu thơ. “Bếp lửa” có lúc sáng mãnh liệt, có lúc yếu, không định hình đã trở thành một đồ dùng, một hình ảnh gần gũi và quen thuộc trong cuộc sống hằng ngày của người dân Việt Nam. Đó không chỉ là nơi để đun nấu mà còn là nơi sum họp, ghi dấu những niềm vui, nỗi buồn của mọi gia đình. Điệp ngữ “một bếp lửa” cùng với các từ láy “chờn vờn”, “ấp iu” đã gợi nên sự ấm áp, đầy tình thương yêu như tấm lòng bà. Từ “ấp iu” gợi lên sự khéo léo của bàn tay bà khi bà nhóm bếp lửa, tấm lòng yêu thương, chi chút của bà đến con cháu. Trong hồi tưởng của cháu, hình ảnh người bà luôn hiện diện cùng bếp lửa qua bao năm tháng. Hình ảnh của bà hiện lên một cách nhẹ nhàng nhưng vô cùng đẹp đẽ trong trái tim người cháu, bà vẫn luôn nhóm bếp lửa mỗi sáng mỗi chiều suốt cả cuộc đời. Hình ảnh “bếp lửa” là biểu hiện cụ thể và sinh động về sự tần tảo, chăm sóc và yêu thương của người bà đối với con cháu trong mọi hoàn cảnh khó khăn, gian khổ. Trước sự hy sinh của bà, người cháu luôn “thương bà biết mấy nắng mưa”. Từ đó làm bật lên tình cảm sâu nặng của người cháu một cách thật tự nhiên, không thể tà xiết vì những “nắng mưa”, khó nhọc vất vả của cuộc đời bà. Từ “thương” diễn đạt rất chân thật mà giản dị không chút hoa mỹ tấm lòng yêu mến bà của cháu.
Đúng 0
Bình luận (0)
Khối lượng khí clo tác dụng vừa đủ với kim loại nhôm tạo ra 26,7 gam AlCl3 là:
A. 12,3 gam.
B. 13,2 gam.
C. 21,3 gam
D. 23,1 gam.
Đáp án C
nAlCl3 = 26,7: 133,5 = 0,2 mol
Bảo toàn nguyên tố Cl: 2nCl2 = 3nAlCl3
=> nCl2 = 1,5nAlCl3 = 1,5.0,2 = 0,3 mol
Đúng 0
Bình luận (0)
Câu 1: Cho a gam magie kim loại tác dụng vừa đủ 11,2 gam brom. Tính a gam và khối lượng muối tạo thành?
Câu 2: Đốt cháy 14,58 gam nhôm kim loại trong bình đựng khí clo (phản ứng vừa đủ), sau phản ứng thu được bao nhiêu gam muối clorua? Tính thể tích khí clo đã phản ứng ỏ đkc
Câu 1:
\(Mg+Br_2\rightarrow MgBr_2\\ n_{Br_2}=\dfrac{11,2}{160}=0,07\left(mol\right)=n_{Mg}=n_{MgBr_2}\\ a=m_{Mg}=0,07.24=1,68\left(g\right)\\ m_{MgBr_2}=184.0,07=12,88\left(g\right)\)
Đúng 2
Bình luận (0)
Mg+Br2->MgBr2
0,07--0,07----0,07
n Br2=\(\dfrac{11,2}{160}\)=0,07 mol
=>m Mg=0,07.24=1,68g
=>m MgBr2=0,07.184=12,88g
Đúng 2
Bình luận (0)
Câu 2:
\(n_{Al}=\dfrac{14,58}{27}=0,54\left(mol\right)\\ 2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ n_{AlCl_3}=n_{Al}=0,54\left(mol\right)\\ n_{Cl_2}=\dfrac{3}{2}.0,54=0,81\left(mol\right)\\ V_{Cl_2\left(đktc\right)}=0,81.22,4=18,144\left(l\right)\\ m_{AlCl_3}=0,54.133,5=72,09\left(g\right)\)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Bài 1: Để điều chế Kali Clorua ( KCl ) người ta cho Kali tác dụng với khí Clo.
a) Nếu có 3.1023 nguyên tử K, cần lấy vào phản ứng bao nhiêu phân tử Cl2 và thu được bao nhiêu KCl ?
b)Giả sử có 1,8.1023 nguyên tử Kali phản ứng. Hãy tính:
+khối lượng theo gam của khí clo phản ứng.
+khối lượng theo gam kcl thu được( theo 2 cách)
c)Tính số nguyên tử Kali có trong 39 gam kim loại Kali. Từ đó tính khối lượng khí clo Để tác dụng vừa đủ với 39 gam kim loại Kali.
d)tính khối lượng Kali Clorua thu đư...
Đọc tiếp
Bài 1: Để điều chế Kali Clorua ( KCl ) người ta cho Kali tác dụng với khí Clo.
a) Nếu có 3.1023 nguyên tử K, cần lấy vào phản ứng bao nhiêu phân tử Cl2 và thu được bao nhiêu KCl ?
b)Giả sử có 1,8.1023 nguyên tử Kali phản ứng. Hãy tính:
+khối lượng theo gam của khí clo phản ứng.
+khối lượng theo gam kcl thu được( theo 2 cách)
c)Tính số nguyên tử Kali có trong 39 gam kim loại Kali. Từ đó tính khối lượng khí clo Để tác dụng vừa đủ với 39 gam kim loại Kali.
d)tính khối lượng Kali Clorua thu được (theo 2 cách) khi cho 39 gam kim loại Kali phản ứng hết với khí clo.
GIẢI NHANH LÊN VỚI!!!
Cho 25,8 gam hỗn hợp axit axetic và rượu etylic tác dụng vừa đủ với kim loại kali thu được 5,6 lít khí hiđro (đktc).
a. Tính thành phần phần trăm theo khối lượng các chất trong hỗn hợp ban đầu.
b. Nếu đun hỗn hợp trên với dung dịch axit sunfuric đậm đặc làm xúc tác thì khối lượng etyl axetat thu được 13,2 gam. Tính hiệu suất phản ứng este hóa?
a) Gọi số mol CH3COOH, C2H5OH là a, b (mol)
=> 60a + 46b = 25,8 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Na + 2CH3COOH --> 2CH3COONa + H2
a------------------------->0,5a
2Na + 2C2H5OH --> 2C2H5ONa + H2
b--------------------->0,5b
=> 0,5a + 0,5b = 0,25 (2)
(1)(2) => a = 0,2 (mol); b = 0,3 (mol)
=> \(\left\{{}\begin{matrix}\%m_{CH_3COOH}=\dfrac{0,2.60}{25,8}.100\%=46,51\%\\\%m_{C_2H_5OH}=\dfrac{0,3.46}{25,8}.100\%=53,49\%\end{matrix}\right.\)
b)
\(n_{CH_3COOC_2H_5}=\dfrac{13,2}{88}=0,15\left(mol\right)\)
PTHH: CH3COOH + C2H5OH --H2SO4(đ),to--> CH3COOC2H5 + H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\) => Hiệu suất tính theo CH3COOH
PTHH: CH3COOH + C2H5OH --H2SO4(đ),to--> CH3COOC2H5 + H2O
0,15<---------------------------------0,15
=> \(H=\dfrac{0,15}{0,2}.100\%=75\%\)
Đúng 5
Bình luận (0)
Bài 6: Cho 12 gam hỗn hợp X gồm 2 kim loại kiềm thổ (nhóm IIA) ở 2 chu kì kế tiếp tác dụng hoàn toàn với a gam dung dịch HCl 18,25% vừa đủ thì thu được 8,96 lit khí ở đktc.
a. Xác định 2 kim loại.
b. Tính khối lượng của từng KL trong hỗn hợp ban đầu.
c. Tính a=?
d. Tính C% các chất trong dung dịch thu được sau phản ứng.
a)
Gọi công thức chung của 2 kim loại là X
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: X + 2HCl --> XCl2 + H2
0,4<------------------0,4
=> \(\overline{M}_X=\dfrac{12}{0,4}=30\left(g/mol\right)\)
Mà 2 kim loại thuộc nhóm IIA, liên tiếp nhau
=> 2 kim loại là Mg, Ca
b) Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Ca}=b\left(mol\right)\end{matrix}\right.\)
=> 24a + 40b = 12 (1)
Và a + b = 0,4 (2)
(1)(2) => a = 0,25 (mol); b = 0,15 (mol)
=> \(\left\{{}\begin{matrix}m_{Mg}=0,25.24=6\left(g\right)\\m_{Ca}=0,15.40=6\left(g\right)\end{matrix}\right.\)
c)
\(n_{HCl}=2.n_{H_2}=0,8\left(mol\right)\)
=> mHCl = 0,8.36,5 = 29,2 (g)
=> \(a=\dfrac{29,2.100}{18,25}=160\left(g\right)\)
d)
mdd sau pư = 12 + 160 - 0,4.2 = 171,2 (g)
\(n_{MgCl_2}=0,25\left(mol\right)\) => \(m_{MgCl_2}=0,25.95=23,75\left(g\right)\)
\(n_{CaCl_2}=0,15\left(mol\right)\) => \(m_{CaCl_2}=0,15.111=16,65\left(g\right)\)
=> \(\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{23,75}{171,2}.100\%=13,87\%\\C\%_{CaCl_2}=\dfrac{16,65}{171,2}.100\%=9,73\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho 24,1 gam hỗn hợp hai kim loại kiềm thuộc hai chu kỳ kế tiếp nhau tác dụng vừa đủ với dung dịch HCl 0,1M. Sau phản ứng thu được 7,84 lít khí (đkc) a. Xác định tên hai kim loại
b. Tính % theo khối lượng mỗi kim loại trong hỗn hợp đầ














