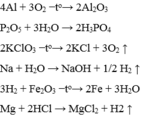Câu 10 : Trình bày sơ đồ và viết phương trình phản ứng điều chế Al, Fe từ quặng chứa Al2O3, Fe2O3, CaCO3.

Những câu hỏi liên quan
Câu 2. Viết phương trình phản ứng theo sơ đồ (ghi rõ điều kiện nếu có)
a. Fe ->(1) FeCl3 -> (2) Fe(OH)3 -> (3) Fe2O3 ->(4)
b.Al ->(1) Al2O3 ->(2) AlCl3 ->(3) Al(OH)3 -> (4) Al2O3
Bs đề câu a: \(Fe_2O_3\xrightarrow{(4)}Fe\)
\(a,(1)2Fe+3Cl_2\xrightarrow{t^o}2FeCl_3\\ (2)FeCl_3+3NaOH\to Fe(OH)_3\downarrow+3NaCl\\ (3)2Fe(OH)_3\xrightarrow{t^o}Fe_2O_3+3H_2O\\ (4)Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2\)
\(b,(1)4Al+3O_2\xrightarrow{t^o}2Al_2O_3\\ (2)Al_2O_3+6HCl\to 2AlCl_3+3H_2\\ (3)AlCl_3+3NaOH\to Al(OH)_3\downarrow+3NaCl\\ (4)2Al(OH)_3\xrightarrow{t^o}Al_2O_3+3H_2O\)
Đúng 2
Bình luận (0)
9. Trong công nghiệp điều chế H2SO4 từ FeS2 theo sơ đồ sau: FeS2 SO2 SO3 H2SO4 a) Viết phương trình phản ứng và ghi rõ điều kiện. b) Tính lượng axit H2SO4 điều chế được từ 1 tấn quặng chứa 60% FeS2. Biết H% của quá trình là 80%.
a)
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
$2SO_2 + O_2 \xrightarrow{t^o,xt} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
b)
$m_{FeS_2} = 1000.60\% = 600(kg)$
$n_{FeS_2} = \dfrac{600}{120} = 5(kmol)$
$n_{FeS_2\ pư} = 5.80\% = 4(kmol)$
$n_{H_2SO_4} = 2n_{FeS_2} = 8(kmol)$
$m_{H_2SO_4} = 8.98 = 784(kg)$
Đúng 1
Bình luận (0)
4FeS2+11O2to→2Fe2O3+8SO2
4FeS2+11O2→to2Fe2O3+8SO2
2SO2+O2to,xt−−→2SO3
2SO2+O2→to,xt2SO3
SO3+H2O→H2SO4
SO3+H2O→H2SO4
b)
mFeS2=1000.60%=600(kg)
mFeS2=1000.60%=600(kg)
nFeS2=600120=5(kmol)
nFeS2 pư=5.80%=4(kmol)
nFeS2 pư=5.80%=4(kmol)
nH2SO4=2nFeS2=8(kmol)
nH2SO4=2nFeS2=8(kmol)
mH2SO4=8.98=784(kg)
Đúng 0
Bình luận (0)
cho hón hợp chất rắn gồm fe2o3, al2o3 hãy trình bày phương pháp điều chế Fe, al từ hh trên
Viết phương trình phản ứng của HCl (nếu có) với: Cu; Al; Fe; Na; Mg; NaOH; Cu(OH)2; Al(OH)3; Al2O3; FeO; Fe2O3; CaCO3; CO2; Na2SO4; Na2SO3; K2CO3; AgNO3.
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Na+2HCl\rightarrow2NaCl+H_2O\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(Cu\left(OH\right)_2+2HCl\rightarrow CuCl_2+2H_2O\)
\(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(Na_2SO_3+2HCl\rightarrow2NaCl+SO_2+H_2O\)
\(K_2CO_3+2HCl\rightarrow2KCl+CO_2+H_2O\)
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
Đúng 7
Bình luận (1)
1.Có 1 hỗn hợp rắn gồm: Al, Fe2O3, Cu, Al2O3. Hãy trình bày sơ đồ tách các chất trên ra khỏi nhau mà không làm thay đổi lượng của mỗi chất. Viết phương trình phản ứng xảy ra.
PTHH:
2Al + 3Cl2 → 2AlCl3
Cu + Cl2 → CuCl2
2AlCl3 + 6NaOH → 2Al(OH)3↓ + 6NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
NaAlO2 + CO2 + H2O → Al(OH)3↓ + NaHCO3
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
2Al(OH)3 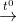 Al2O3 + 3H2O
Al2O3 + 3H2O
Cu(OH)2 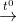 CuO + H2O
CuO + H2O
2Al2O3 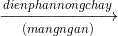 4Al + 3O2
4Al + 3O2
P/s Nhớ tick cho mình nha. Thanks bạn
Đúng 1
Bình luận (0)
PTHH:
2Al + 3Cl2 → 2AlCl3
Cu + Cl2 → CuCl2
2AlCl3 + 6NaOH → 2Al(OH)3↓ + 6NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
NaAlO2 + CO2 + H2O → Al(OH)3↓ + NaHCO3
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
2Al(OH)3 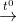 Al2O3 + 3H2O
Al2O3 + 3H2O
Cu(OH)2 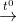 CuO + H2O
CuO + H2O
2Al2O3 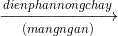 4Al + 3O2
4Al + 3O2
Đúng 0
Bình luận (0)
Cho sơ đồ các phản ứng sau:
A
l
+
O
2
−
t
o
→
A
l
2
O
3
P
2
O
5
+
H
2
O
→
H
3
P
O
4
...
Đọc tiếp
Cho sơ đồ các phản ứng sau:
A l + O 2 − t o → A l 2 O 3 P 2 O 5 + H 2 O → H 3 P O 4 K C l O 3 − t o → K C l + O 2 N a + H 2 O → N a O H + H 2 H 2 + F e 2 O 3 − t o → F e + H 2 O M g + H C l → M g C l 2 + H 2
Hãy chọn hệ số và viết thành phương trình hóa học.
quặng boxit có thành phần chủ yếu là Al2O3 để điều chế Al ta điện phân 150g quặng boxit thu được 54g Al và 48g O2 phản ứng xảy ra theo sơ đồ Al2O3----->Al+O2
a, viết công thức tính khối lượng của phản ứng
b, tính khối lượng Al2O3 đã phản ứng
c, tính phần trăm khối lượng của Al2O3 trong quặng boxit.
a) Theo định luật bào toàn khối lượng , ta có :
mAl2O3 = mAl + mO2
b) Ta có :
mAl2O3 = 54 + 48 = 102 (g)
c) %mAl2O3 = \(\frac{102.100}{150}\%=68\%\)
Đúng 0
Bình luận (0)
a)
- PTHH: \(Al_2O_3\rightarrow Al+O_2\)
- Công thức về khối lượng: \(m_{Al_2O_3}=m_{Al}+m_{O_2}\)
b)
\(m_{Al_2O_3}=m_{Al}+m_{O_2}\)
hay \(m_{Al_2O_3}=54+48\)
\(\Rightarrow m_{Al_2O_3}=102\left(g\right)\)
c)
Phần trăm: \(m_{Al_2O_3}\) = \(m_{Al_2O_3}\) / m quặng boxit
\(\frac{150}{102}.100\%=1,5\%\)
câu c mk cũng hk chắc nha bạn!!!!!!!!!
Đúng 0
Bình luận (3)
Câu 2: a.Từ quặng pirit, NaCl và nước, viết các phương trình phản ứng điều chế: SO2 Fe(OH)3, Na2SO3, Fe, Fe(OH)2.
b.Từ những chất sau: Cu, C, S, Na2SO3, FeS2, O2, H2SO4, viết tất cả các phương trình phản ứng có thể dùng để điều chế SO2. Ghi rõ điều kiện phản ứng nếu có
Hơi lệch một chút, cái này liên quan đến hóa ạ :( mình sắp ktra 1 tiết rồi mong mn thông cảmQuặng boxit là có thành phần chủ yếu Al2O3. Để điều chế nhôm người ta liền phân 150g quặng boxit thu được 54g Nhôm Al và 48gam khí Oxi (O2) phản ứng xảy ra theo sơ đồ sau: Al2O3 - Al +O2a) Viết công thức về khối lượng của phản ứng và dựa vào sơ đồ trên viết PTHHb)Tính khối lượng Al2O3 đã phản ứngc) Tính tỉ lệ% của khối lượng Al2O3 chứa trong quặng boxit đó ??
Đọc tiếp
Hơi lệch một chút, cái này liên quan đến hóa ạ :( mình sắp ktra 1 tiết rồi mong mn thông cảm
Quặng boxit là có thành phần chủ yếu Al2O3. Để điều chế nhôm người ta liền phân 150g quặng boxit thu được 54g Nhôm Al và 48gam khí Oxi (O2) phản ứng xảy ra theo sơ đồ sau: Al2O3 -> Al +O2
a) Viết công thức về khối lượng của phản ứng và dựa vào sơ đồ trên viết PTHH
b)Tính khối lượng Al2O3 đã phản ứng
c) Tính tỉ lệ% của khối lượng Al2O3 chứa trong quặng boxit đó ??
chị vào chỗ này là sẽ có đáp án đấy:Câu hỏi của Đào Minh Anh - Hóa học lớp 8
Đúng 0
Bình luận (0)