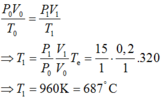Một xilanh chứa 150 c m 3 khí ở áp suất 2 . 10 5 P a . Pit-tông nén khi trong xilanh xuống còn 100 c m 3 . Tính áp suất của khí ttrong xilanh lúc này, coi nhiệt độ như không đổi.
A. 3 . 10 - 5 P a
B. 3.105 Pa
C. 3 . 10 4 P a
D. 1 , 3 . 10 5 P a
Một xilanh chứa 150cm3 khí ở áp suất 2 . 105 Pa . Pit - tông nén khí trong xilanh xuống còn 100 cm3 . Tính áp suất của khí trong xilanh lúc này , coi nhiệt độ như không đổi .
Ta có : p1 = 2 . 105 Pa
V1 = 150 cm3
V2 = 100 cm3
T = const
Áp dụng định luật Boyle - Mariotle ta có :
P1 V1 = P2 V2 → P2 = \(\frac{p_1V_1}{V_2}\) = \(\frac{2.10^5.150}{100}\)= 3 . 105 Pa
Đáp số : 3 . 105 Pa
Bài giải:
Trạng thái 1: p1 = 2 . 105 pa
V1 = 150 cm3
Trạng thái 2: p2 = ?
V2 = 100 cm3
Nhiệt độ không đổi. Theo định luật Bôi-lơ – Ma-ri-ốt: p1V1 = p2V2.
=> P2 = =
= 3 . 105 Pa
Yêu tiếng Anh trả lời sau và copy bài Nguyen Quang Trung
một xilanh chứa 150 cm3 khí ở áp suất 2.105 Pa . Pit-tông nén khí xilanh xuống còn 100 cm3 . Tính áp suất của khí trong xilanh lúc này , coi như nhiệt độ không đổi
Quá trình đẳng nhiệt: \(P_1V_1=P_2V_2\Rightarrow P_2=\dfrac{P_1V_1}{V_2}=\dfrac{2.10^5.150}{100}=3.10^5 \,Pa\)
Một xilanh chứa 150cm3 khí ở áp suất 2.105 Pa.Pit-tông nén khí trong xilanh xuống còn 100cm3. Tính áp suất của khí trong xilanh lúc này, coi nhiệt độ như không đổi.
Quá trình đẳng nhiệt: \(P_1V_1=P_2V_2\Rightarrow P_2=\dfrac{P_1V_1}{V_2}\)
\(=\dfrac{2\cdot10^5\cdot150}{100}=3\cdot10^5Pa\)
Một xilanh chứa 150cm3 khí ở áp suất 2.105 Pa.Pit-tông nén khí trong xilanh xuống còn 100cm3.Tính áp suất của khí trong xilanh lúc này, coi nhiệt độ như không đổi.
một xilanh chứa 200 cm3 khí ở áp suất 3.105 Pa . Pit-tông nén khí xilanh xuống còn 100 cm3 . Tính áp suất của khí trong xilanh lúc sau , coi như nhiệt độ không đổi
cu ap dung cong thuc la ra, giai:
Xét lượng khí trong xi lanh.
Áp dụng định luật Bôilơ – Mariốt ta có:
\(p_1V_1=p_2V_2\Rightarrow p_2=\dfrac{p_1V_1}{V_2}=\dfrac{3.10^5.200}{100}=600000\left(Pa\right)\)
Một khối khí trong xilanh lúc đầu có hai áp suất 2 atm nhiệt độ 27°c và thể tích 150 cm³ khi pittông nén khí đến 50 cm³ và áp suất 10 atm thì nhiệt độ cuối cùng của khối khí là bao nhiêu
P1=2atm
T1=27+273=300k
V1=150cm3=0,15l
P2=10atm
V2=50cm3=0,05l
T2=? K
Giai
P1.V1/T1=P2.V2/T2
2.0,15/300=10.0,05/T2
=> T2= 500K
Trong xilanh của một động cơ có chứa một lượng khí ở nhiệt độ 470C và áp suất 0,7 atm.Sau khi bị nén thể tích của khí giảm đi 5 lần và áp suất tăng lên tới 8 atm. Tính nhiệt độ của khí ở cuối quá trình nén?
A. 7310C
B. 320 K
C. 3200C
D. 731K
Đáp án D
TT1
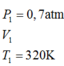
TT2

áp dụng PTTT khí lí tưởng
ta có:
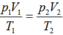
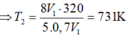
Một xilanh có pit-tông cách nhiệt đặt nằm ngang. Pit-tông ở vị trí chia xilanh thành hai phần bằng nhau, chiều dài của mỗi phần là 30 cm. Mỗi phần chứa một lượng khí như nhau ở nhiệt độ 17 ° C và áp suất 2 atm. Muốn pit-tông dịch chuyển 2 cm thì phải đun nóng khí ở một phần lên thêm bao nhiêu độ ? Áp suất của khí khi pit-tông đã dịch chuyển là bao nhiêu ?
Đối với phần khí bị nung nóng:
+ Trạng thái đầu: p 1 ; V 1 = lS; T 1 (1)
+ Trạng thái cuối: p 2 ; V 2 = (l + ∆ l)S; T 2 (2)
Đối với phần khí không bị nung nóng:
+ Trạng thái đầu: p 1 ; V 1 = lS; T 1 (1)
+ Trạng thái cuối: p ' 2 ; V ' 2 = (l - ∆ l)S; T ' 2 = T 1 (2)
Ta có:
p 1 V 1 / T 1 = p 2 V 2 / T 2 = p ' 2 V ' 2 / T 1
Vì pit-tông ở trạng thái cân bằng nên p ' 2 = p 2 . Do đó
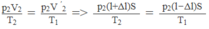
⇒ T 2 = (l + ∆ l/l - ∆ l). T 1
Vậy phải đun nóng khí ở một bên lên thêm ∆ T độ:
![]()
Vì p 1 V 1 / T 1 = p 2 V 2 / T 2 nên:
![]()
Thay số vào ta được:
p 2 ≈ 2,14(atm)
Một xilanh của một động cơ có thể tích 1 dm3 chứa hỗn hợp khí ở nhiệt độ 470C và áp suất 1atm. Khi động cơ hoạt động, pittong nén xuống làm cho thể tích của hỗn hợp khí trong xilanh chỉ còn 0,2dm3 và áp suất tron xilanh tăng lên tới 15 atm. Hãy tính nhiệt độ của hỗn hợp khí trong xilanh khi động cơ hoạt động.
A. 4800C
B. 320 K
C. 2070C
D. 4700C
: Đáp án C
Gọi ![]() lần lượt là áp suất,
lần lượt là áp suất,
thể tích và nhiệt độ của khối khí trong xilanh ở trạng thái ban đầu
![]()
![]()
Gọi ![]()
lần lượt là áp suất, thể tích và nhiệt độ của khối khí trong xilanh khi động cơ hoạt động.
![]()
Từ phương trình trạng thái của khí lí tưởng, ta có: