Nguyên tử của nguyên tố X có tổng số hạt mang điện trong hạt nhân là 13. Vị trí của X trong bảng tuần hoàn là
A. Chu kỳ 3, nhóm IIIA.
B. Chu kỳ 2, nhóm IIIA.
C. Chu kỳ 3, nhóm IIA.
D. Chu kỳ 3, nhóm VIIA.
Câu 8: Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 13+, có 3 lớp electron, lớp ngoài cùng có 3 electron. Vị trí của X trong bảng tuần hoàn là
A. chu kỳ 3, nhóm II.
B. chu kỳ 3, nhóm III.
C. chu kỳ 2, nhóm II.
D. chu kỳ 2, nhóm III
Nguyên tử của nguyên tố X cố tổng số các hạt (p, n, e) bằng 40. Biết số khối A < 28. Trong bảng tuần hoàn các nguyên tố hóa học, X thuộc
A. chu kì 3, nhóm IIIA
B. chu kì 2, nhóm IIIA
C. chu kì 4, nhóm IIIA
D. chu kì 3, nhóm IIA
Theo đề bài ta có : 2Z + N = 40
N ≥ Z . Vì vậy ta có : 3Z ≥ 40, do đó Z ≤ 40/3 = 13,3 (1)
Măt khác : N/Z ≤ 1,5 → N ≤ 1,5Z
Từ đó ta có : 2Z + N ≤ 2Z + 1,5Z; 40 ≤ 3,5Z
→ Z ≥ 40/3,5 = 11,4 (2)
Tổ hợp (1) và (2) ta có : 11,4 ≤ Z ≤ 13,3 mà z nguyên. Vậy Z= 12 và Z = 13.
Nếu Z = 12 thì N = 16 và A = 28 (trái với đề bài A < 28)
Vậy Z = 13. Đó là nguyên tố nhôm (Al).
Vị trí của nhôm trong bảng tuần hoàn :
+ Ô số 13 ;
+ Chu kì 3 ;
+ Nhóm IIIA.
Trắc nghiệm
Câu 16: Hạt nhân nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Vị trí và tính
chất của A trong bảng tuần hoàn là
A. chu kì 2, nhóm IIA, là kim loại. B. chu kì 3, nhóm IIA, là kim loại.
C. chu kì 2, nhóm IA, là phi kim. D. chu kì 3 nhóm IA, là phi kim.
Câu 17: Nguyên tố nào sau đây là khí hiếm?
A. Hydrogen B. Helium C. Nitrogen D. Sodium
Câu 18: Phần trăm về khối lượng của nguyên tố K trong phân bón KNO3 là:
A. 38,6% B. 47,5% C. 13,9% D. 27,8%
Câu 5: Hóa trị của Aluminium tron hợp chất Al2O3 là
A. I B. II C. III D. IV
Câu 19: Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số thứ tự ô
nguyên tố A trong bảng tuần hoàn các nguyên tố hóa học là:
A. 12 B. 24 C. 13 D. 6
Câu 20: Liên kết được hình thành trong phân tử muối ăn là
A. liên kết cộng hóa trị B. liên kết ion
C. liên kết hydrogen D. liên kết kim loại
Cái này chắc hóa 7 không vậy fen=))
C16:
\(2p+12=24\Rightarrow p=6:Cacbon:1s^22s^22p^2\)
Chu kì 2, nhóm IVA, là phi kim (có 4 e hóa trị lớp ngoài cùng)
Đề cho đáp án sai, sure=0
C17: B
C18: \(\%K=\dfrac{39.100}{39+14+16.3}=38,61\%\)
Chọn A
C19: \(p+12=24\Rightarrow p=12\) => ô 12
Chọn A
C20: liên kết ion
Liên kết ion của 2 nguyên tử trong 1 phân tử là lấy giá trị tuyệt đối của hiệu độ âm điện của 2 nguyên tử tính ra lớn hoặc bằng 1,7.
X và Y là 2 nguyên tố thuộc hai chu kỳ liên tiếp nhau trong cùng một nhóm A của bảng tuần hoàn, X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 32. X, Y là
A. Na(Z=11) và K(Z=19).
B. Si(Z=14) và Ar(Z=18).
C. Al(Z=13) và K(Z=19).
D. Mg(Z=12) và Ca(Z=20).
Đáp án D
Hai nguyên tố thuộc cùng một nhóm A, thuộc hai chu kỳ liên tiếp = Điện tích hạt nhân cách nhau 8, 18 hay 32
Trường hợp 1:
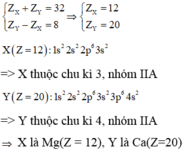
Trường hợp 2:
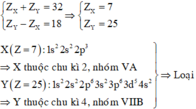
Trường hợp 3:
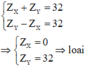
cho hai nguyên tố X Y nằm ở hai chu kỳ liên tiếp thuộc cùng một nhóm A trong bảng tuần hoàng và có tổng điện tích hạt nhân là 32
- xác định điện tích hạt nhân của X Y
- cấu hình electrong X,Y
- vị trí trong bng3 tuần hoàn , tính chất
-so sánh tính kim loại / phi kim và tính acid / base của X Y
số hạt P trong hai nguyên tử x và y thuộc 2 nhóm A liên tiếp ở chu kỳ 4 là 39 Tìm tên ký hiệu nguyên tố đến vị trí trong bảng tuần hoàn hóa học của x và y
Vì 2 nguyên tố X, Y thuộc 2 nhóm A liên tiếp nên: \(\left\{{}\begin{matrix}Z_X+Z_Y=39\\Z_Y-Z_X=1\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}Z_X=19\\Z_Y=20\end{matrix}\right.\)
ZX=19 => Cấu hình e: \(1s^22s^22p^63s^23p^64s^1\)
=> X thuộc ô 19 là Kali (K), nhóm IA, chu kỳ IV
ZX=20 => Cấu hình e: \(1s^22s^22p^63s^23p^64s^2\)
=> X thuộc ô 20 là Canxi (Ca), nhóm IIA, chu kỳ IV
Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52. Trong hạt nhân nguyên tử X có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Vị trí (chu kì, nhóm) của X trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VA
B. chu kì 3, nhóm VIIA
C. chu kì 2, nhóm VA
D. chu kì 2, nhóm VIIA
Hai nguyên tố X, Y thuộc cùng chu kì 4 , thuộc 2 nhóm A kế tiếp nhau ; tổng số điện tích hạt nhân của X, Y là 51. Hai nguyên tố X, Y thuộc các nhóm A. IA và IIA B. IIA và IIIA C. IIIA và IVA D. VA và VIA
Zx+zy=51
Hai nhóm liên kết nhau ở chu kỳ 4
=> TH1: zy-zx=1
=>TH2: zy-zx=11
Nguyên tố X thuộc chu kỳ 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là?
A.1.
B. 3.
C. 4.
D. 2.
Chọn B
Số lớp electron của X bằng số thứ tự chu kỳ và bằng 3.
Nguyên tố hóa học nhôm (Alo) có số hiệu nguyên tử là 13, chu kỳ 13, nhóm IIIA điều khẳng định nào sau đây về Al là sai A. Hạt nhân nguyên tử nhôm có 13 proton B. Số electron ở vỏ nguyên tử của nguyên tố đó là 13 C. Nguyên tố hóa học này là một kim loại D. Vỏ nguyên tử có 3 lớp electron và lớp ngoài cùng có 2 electron