Đốt cháy hoàn toàn 4,10 g chất hữu cơ A người ta thu được 2,65 g N a 2 C O 3 ; 1,35 g H 2 O và 1,68 lít C O 2 (đktc).
Xác định công thức đơn giản nhất của chất A.
\(n_C = n_{CO_2} = \dfrac{8,8}{44} = 0,2(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{7,2}{18} = 0,8(mol)\\ n_O = \dfrac{6,4-0,2.12-0,8}{16} = 0,2\\ \text{Ta có :}\\ n_C : n_H : n_O = 0,2 : 0,8 : 0,2 = 1 : 4 : 1\\ \text{CTPT của A : } (CH_4O)_n\\ M_A = (12 + 4 + 16)n = 32\Rightarrow n = 1\\ \text{Vậy CTPT của A :} CH_4O\\ \text{CTCT của A :}\\\)
\(CH_3-O-H\\ \)
Gọi CTPT của hợp chất hữu cơ A là CxHyOz.
CxHyOz + (2x + y/2 - z) O2 ---to-----> xCO2 + y/2 H2O
x = nCO2/nA = 0.2/0.2 = 1
y = 2nH2O/nA = 0,8/0,2 = 4
==> CTPT của A là CH4Oz
mà MA = 32 = 12 + 4 + 16z
--> z = 1
==> CTPT của A là CH4O
đốt cháy hoàn toàn 2,3 g một hợp chất hữu cơ A , người ta thu được 2,24 lít khí C02 và 2,7 gam nước
a hãy viết ctpt của hchc A
b hãy viết ctct của A ( biết A có ptk=46)
Hợp chất A gồm C,H và có thể có O
\(n_C=n_{CO_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(n_H=2.n_{H_2O}=2.\dfrac{2,7}{18}=0,3mol\)
\(n_O=\dfrac{2,3-\left(0,1.12+0,3.1\right)}{16}=0,05mol\)
\(\Rightarrow CT:C_xH_yO_z\)
\(x:y:z=0,1:0,3:0,05=2:6:1\)
\(\Rightarrow CPPT:C_2H_6O\)
\(\left(C_2H_6O\right)n=46\)
\(\Rightarrow n=1\)
\(CTCT:CH_3-CH_2-OH\)
$a\big)$
Bảo toàn C: $n_C=n_{CO_2}=\frac{2,24}{22,4}=0,1(mol)$
Bảo toàn H: $n_H=2n_{H_2O}=2.\frac{2,7}{18}=0,3(mol)$
$\to n_O=\frac{2,3-0,1.12-0,3}{16}=0,05(mol)$
$\to n_C:n_H:n_O=0,1:0,3:0,05=2:6:1$
$\to$ CT nguyên là $(C_2H_6O)_n$
Mà $M_A=46(g/mol)$
$\to (12.2+6+16).n=46$
$\to n=1$
Vậy CTPT của A là $C_2H_6O$
$b\big)$
$CH_3-CH_2-OH$
$CH_3-O-CH_3$
Đốt cháy hoàn toàn 2,20 g chất hữu cơ A, người ta thu được 4,40 g C O 2 và 1,80 g H 2 O .
1. Xác định công thức đơn giản nhất của chất A.
2. Xác định công thức phân tử chất A biết rằng nếu làm bay hơi 1,10 g chất A thì thể tích hơi thu được đúng bằng thể tích của 0,40 g khí O 2 ở cùng nhiệt độ và áp suất.
1. C 2 H 4 O .
2. Số mol A trong 1,10 g A = số mol O 2 trong 0,40 g O 2
n
O
2

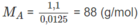
( C 2 H 4 O ) n = 88 ⇒ 44n = 88 ⇒ n = 2
CTPT là C 4 H 8 O 2 .
Đốt cháy hoàn toàn 1,5 g hợp chất hữu cơ A thu được 4,4 g CO2 và 2,7 g H2O. Xác định CTPT của A, biết A nặng hơn khí Heli 7,5 lần
\(M_A=7,5.4=30\left(\dfrac{g}{mol}\right)\\ Hợp.chất.hữu.cơ.A:n_C=n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\\ n_{H_2O}=\dfrac{2,7}{18}=0,15\left(mol\right)\Rightarrow n_H=2.0,15=0,3\left(mol\right)\\ m_C+m_H=0,1.12+0,3.1=1,5\left(g\right)\\ \Rightarrow A:không.có.oxi\\ Đặt.A:C_aH_b\left(a,b:nguyên,dương\right)\\ a:b=n_C:n_H=0,1:0,3=1:3\\ \Rightarrow CTTQ:\left(CH_3\right)_n\\ M_{\left(CH_3\right)_n}=30\\ \Leftrightarrow15n=30\\ \Leftrightarrow n=2\\ \Rightarrow A:C_2H_6\)
Đốt cháy hoàn toàn 2g chất hữu cơ A chứa C, H, O thu được 4,4 g CO2 và 1,792 l hơi ( đktc ). Biết tỉ khối hơi của A so với hidro là 100. Xác định công thức phân tử của A
Ta có: \(d_{A/H_2}=100\)
\(\Rightarrow M_A=100.2=200\left(g/mol\right)\)
\(\Rightarrow n_A=\dfrac{2}{200}=0,01\left(mol\right)\)
\(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\Rightarrow n_C=0,1\left(mol\right)\)
⇒ Số nguyên tử C trong A là: \(\dfrac{0,1}{0,01}=10\)
\(n_{H_2O}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\Rightarrow n_H=0,08.2=0,16\left(mol\right)\)
⇒ Số nguyên tử H trong A là: \(\dfrac{0,16}{0,01}=16\)
Giả sử n là số nguyên tử O có trong A.
Ta có: 10.12 + 16 + n.16 = 200
⇒ n = 4
Vậy: CTPT của A là C10H16O4.
Bạn tham khảo nhé!
Bảo toàn nguyên tố với C,H :
\(n_C = n_{CO_2} = \dfrac{4,4}{44}= 0,1(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{1,792}{22,4} = 0,16(mol)\)
Mà :
\(m_O = m_A - m_C - m_H = 2 - 0,1.12 - 0,16 = 0,64(gam)\\ \Rightarrow n_O = \dfrac{0,64}{16} = 0,04(mol)\)
Ta có :
\(n_C: n_H : n_O = 0,1 :0,16 : 0,04 = 5 : 8 : 2\)
Vậy CTPT của A là : \((C_5H_8O_2)_n\)
Mà :
\(M_A = (12.5+8+16.2)n = M_{H_2}.100 = 200(đvC)\\ \Rightarrow n = 2\)
Vậy CTPT của A : \(C_{10}H_{16}O_4\)
Đốt cháy hoàn toàn 6,2g hợp chất hữu cơ A chứa C,H,N thu được 8,8 g CO2 và 2,24 lit N2(đktc) và H2O. Biết MA .=31 .a/ Xác định công thức phân tử của hợp chất hữu cơ.A b/ viết CTCT A biết N vó hóa trị. III.
a, Gọi CTPT của A là CxHyNz.
Ta có: \(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)=n_C\)
\(n_{N_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow n_N=0,1.2=0,2\left(mol\right)\)
\(\Rightarrow m_H=6,2-m_C-m_N=1\left(g\right)\Rightarrow n_H=\dfrac{1}{1}=1\left(mol\right)\)
\(\Rightarrow x:y:z=0,2:1:0,2=1:5:1\)
→ CTĐGN của A là (CH5N)n.
\(\Rightarrow n=\dfrac{31}{12+5+14}=1\)
→ CTPT của A là CH5N.
b, CTCT: CH3NH2.
4: Đốt cháy hoàn toàn 2,2 g chất hữu cơ A, được 4,4 g CO2 và 1,8 g H2O
Xác định CTĐGN của chất A
nCO2=0,1(mol) nH2O=0,1(mol)
mO(trong A)=2,2 - mC - mH=2,2-0,1.12-0,1.2=0,8 (g)
nO(trong A)=\(\dfrac{0,8}{16}=0,05\left(mol\right)\)
Gọi CTĐGN của hợp chất A là CxHyOz
Ta có x:y:z=nC:nH:nO=0,1:0,1:0,05=2:2:1
Vậy CTĐGN của hợp chất A là C2H2O
Anh chị làm ơn giúp e mấy bài này ạ.E cảm ơn!
Bài 1:
Khi đốt cháy hoàn toàn một lượng hợp chất hữu cơ X cần 0,8 gam O2 người ta thu được 1,1 gam CO2,0,45 gam H2O và không có sản phẩm nào khác. Xác định công thức phân tử của X. Biết rằng khi cho bay hơi hoàn toàn 0,6gam X ở điều kiện nhiệt độ và áp suất thích hợp đã thu được một thể tích hơi đúng bằng thể tích hơi của 0,32 gam O2 trong cùng điều kiện.
Bài 2:
Đốt cháy hoàn toàn một hợp chất hữu cơ A có thành phần C,H,O thu được CO2 có thể tích bằng 3/4 thể tích hơi nước và bằng 6/7 thể tích O2 dùng để đốt cháy. Mặt khác, 1l hơi A có khối lượng bằng 46 lần khối lượng 1 lít H2 ở cùng điều kiện.Tìm công thức phân tử của A.
Bài 3: Đốt cháy hoàn toàn 4,3 gam hợp chất hữu cơ thu được 6,72 lít CO2 và 0,35 mol H2O. Khi đốt cháy hoàn toàn 1 mol chất A cần 212,8l O2.Xác định CTPT của A.
Đốt cháy hoàn toàn 6 gam hợp chất hữu cơ A chỉ thu được 8,8 g CO2 và 3,6 g nước. Xác điinhj CTPT của A biết khi Hóa hơi 3 gam A thu được thể tích bằng thể tích của 1,6 gam O2 ( cùng điều kiện nhiệt độ, áp suất) Giải theo 3 cách! Mọi người giúp mình gấp với ạ ^^
Ta có \(n_{CO_2}=\dfrac{8,8}{44}=0,2(mol);n_{H_2O}=\dfrac{3,6}{18}=0,2(mol)\)
Bảo toàn C và H: \(n_{C}=0,2(mol);n_{H}=0,4(mol)\)
\(\Rightarrow m_A=m_C+m_H=0,2.12+0,4.1=2,8<6\)
Do đó A chứa O
\(\Rightarrow m_O=6-2,8=3,2(g)\\ \Rightarrow n_O=\dfrac{3,2}{16}=0,2(mol)\)
Đặt \(CTHH_A:C_xH_yO_z\)
\(\Rightarrow x:y:z=0,2:0,4:0,2=1:2:1\\ \Rightarrow CTPT_A:CH_2O\)