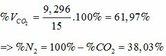Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit HCl dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là
A. 6,72 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 67,2 lít.
Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit sunfuric loãng, dư.
Thể tích khí hiđro (đktc) được giải phóng sau phản ứng là
A. 4,48 lít. B. 2,24 lít
C. 6,72 lít. D. 67,2 lít.
Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit HCl dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là
A. 6,72 lít
B. 2,24 lít
C. 4,48 lít
D. 67,2 lít
Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit HCl dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là
A. 6,72 lit
B. 2,24 lit
C. 4,48 lit
D. 67,2 lit
Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit HCl dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là
A. 6,72 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 67,2 lít.
Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit HCl dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là
A. 6,72 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 67,2 lít.
Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit sunfuric loãng dư. Thể tích khí hiđro (đktc) được giải phóng sau phản ứng là ?
Hoà tan hoàn toàn 14,6 gam hỗn hợp X gồm Al và Sn bằng dung dịch HCl (dư), thu được 5,6 lít khí H2 (ở đktc). Thể tích khí O2 (ở đktc) cần để phản ứng hoàn toàn với 14,6 gam hỗn hợp X là:
A. 2,80 lít B. 1,68 lít C. 4,48 lít D. 3,92 lít
Gọi nAl = x mol ; nSn = y mol → 27x + 119y = 14,6 (1) ; nH2 = 0,25 mol
- Khi X tác dụng với dung dịch HCl:
quá trình oxi hóa:
Al -> Al3 + +3e
x -> 3x
Sn -> Sn2+ +2e
y -> 2y
Qúa trình khử
2H+ + 2e -> H2
0,5<- 0,25
=> 3x+2y=0,5 (2)
(1)(2) => x=y=0,1mol
- Khi X tác dụng O2
quá trình oxi hóa
Al -> Al3 + +3e
x -> 3x
Sn -> Sn4+ +4e
y -> 4y
Qúa trình khử
O2 + 4e -> 2O2-
VO2 = ((3x +4y)/4).22,4 = ((3.0,1+4.0,1)/4).22,4 = 3,92l => D
Cho Al tác dụng với 100ml dung dịch HCl là 2M thì thể tích khí thu được sau phản ứng (ở đktc) là A.2,24 lít B.6,72 lít C.4,48 lít D.3,36 lít
Cho 13,8 gam hỗn hợp X gồm kim loại kiềm R và Ca tác dụng hết với nước thu được 5,6 lít H2 (đktc) và dung dịch Y. Mặt khác, cho 8,58 gam kim loại R phản ứng hết với lượng dư dung dịch HCl thì thể tích khí H2 thoát ra lớn hơn 2,24 lít (đktc).
1. Tìm kim loại R?
2. Cho 15 lít hỗn hợp khí Z gồm N2 và CO2 (đktc) vào dung dịch Y. Sau khi phản ứng kết thúc thu được 8,5 gam kết tủa. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp Z?
1.
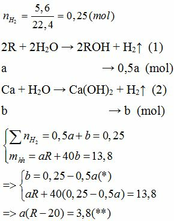
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
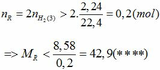
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
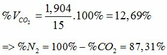
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)