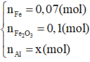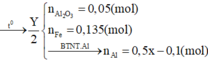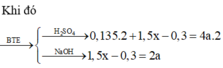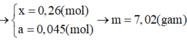Cho 4,72 gam hỗn hợp bột gồm các chất Fe, FeO và Fe2O3 tác dụng với CO ở nhiệt độ cao. Phản ứng xong thu được 3,92 gam Fe. Nếu ngâm cùng lượng hỗn hợp các chất trên trong dung dịch CuSO4 dư, phản ứng xong khối lượng chất rắn thu được là 4,96 gam. Khối lượng (gam) Fe, Fe2O3 và FeO trong hỗn hợp ban đầu lần lượt là
A. 1,68; 1,44; 1,6
B. 1,6; 1,54; 1,64
C. 1,6; 1,44; 1,64
D. 1,68; 1,6; 1,44