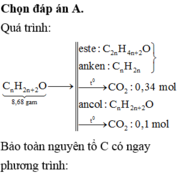
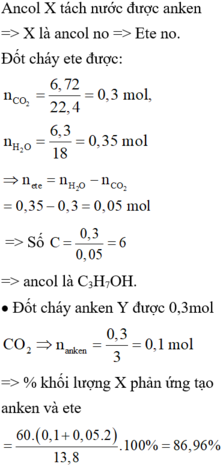Đun nóng 8,68 gam hỗn hợp X gốm các ancol no, đơn chức, mạch hở với H2SO4 đặc, thu được hỗn hợp Y gồm: ete (0,04 mol), anken và ancol dư. Đốt cháy hoàn toàn lượng anken và ete trong Y, thu được 0,34 mol CO2. Nếu đốt cháy hết lượng ancol trong Y thì thu được 0,1 mol CO2 và 0,13 mol H2O. Phần trăm số mol ancol tham gia phản ứng tạo ete là
A. 21,43%.
B. 26,67%.
C. 31,25%.
D. 35,29%