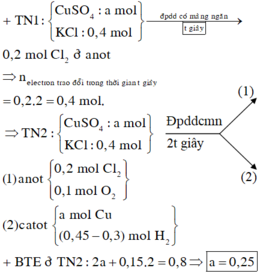
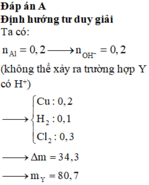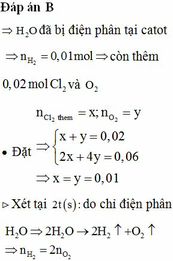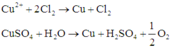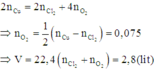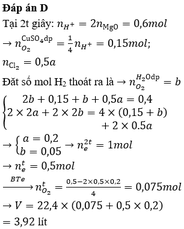Điện phân dung dịch chứa a mol C u N O 3 2 (điện cực trơ, hiệu suất 100%) với cường độ dòng điện không đổi I = 1,93A. Sau thời gian 2h thì thu được dung dịch X. Cho 10,4 gam Fe vào X, sau khi các phản ứng xảy ra hoàn toàn thì thu được khí NO (sản phẩm khử duy nhất) và 8 gam hỗn hợp kim loại. Giá trị của a là
A. 0,150
B. 0,200
C. 0,155
D. 0,300