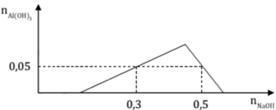
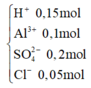
Chia 1 lit dung dịch X có chứa các ion: H + , A l 3 + , S O 4 2 - và C l - 0,1M, thành hai phần bằng nhau. Nhỏ từ từ đến dư dung dịch NaOH vào phần 1, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
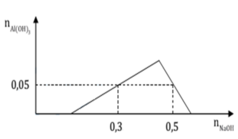
Mặt khác cho 300 ml dung dịch B a O H 2 0,6M tác dụng với phần 2, thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là (biết các phản ứng xảy ra hoàn toàn)
![]()
![]()
![]()
![]()