Đem 100ml dung dịch C H 3 C O O H 1M tác dụng với 6,9 g C H 3 C H 2 O H thu được 6,6 g C H 3 C O O C 2 H 5 . Tính hiệu suất phản ứng. (Cho H=1, C=12, O=16)

Những câu hỏi liên quan
Cho 8g SO3 tác dụng hết với 92ml H2O thu được dung dịch A. Cho 6,2g Na2O hòa tan hết vào 93,8 ml H2O thu được dung dịch B. (khối lượng riêng của H2O là 1g/ml). Trộn nửa dung dịch A với nửa dung dịch B thu được 100ml dung dịch C.
a) Tính C% của dung dịch A và dung dịch B
b) Tính CM của dung dịch C.
bạn vô trang hóa này đi sẽ có nhiều người giúp bạn https://www.facebook.com/groups/1515719195121273/
Đúng 0
Bình luận (0)
Cho 6,9 gam một kim loại kiềm vào 200ml dung dịch HCl thu được 3,36 lít khí H2 (dktc) và dung dịch X vào 100ml dung dịch AlCl3 1M thì thu được 5,46 gam kết tủa. Xác định kim loại kiềm và nồng độ mol của dung dịch HCl.
https://hoc24.vn/hoi-dap/question/640238.html
Đúng 0
Bình luận (0)
1/ Hòa tan m(g) Na2O vào nước thu được dung dịch A. Trung hòa A cần 200ml dung dịch gồm HCl 0,5M và H2SO4 0,25M. Tìm m ?
2/ Trộn 100ml dung dịch H2SO4 1,1M với 100ml dung dịch NaOH 1M thì thu được dung dịch A. Cho vào dung dịch A 1,35g Al thì thu được thể tích H2 ở đktc là bao nhiêu ?
3/ Dung dịch X có thể tích 300ml chứa Ca(OH)2 0,3M có thể hấp thụ tối đa nao nhiêu lít CO2 (ở đktc) ?
Đọc tiếp
1/ Hòa tan m(g) Na2O vào nước thu được dung dịch A. Trung hòa A cần 200ml dung dịch gồm HCl 0,5M và H2SO4 0,25M. Tìm m ?
2/ Trộn 100ml dung dịch H2SO4 1,1M với 100ml dung dịch NaOH 1M thì thu được dung dịch A. Cho vào dung dịch A 1,35g Al thì thu được thể tích H2 ở đktc là bao nhiêu ?
3/ Dung dịch X có thể tích 300ml chứa Ca(OH)2 0,3M có thể hấp thụ tối đa nao nhiêu lít CO2 (ở đktc) ?
Bài 1:
nHCl = 0,5 . 0,2 = 0,01 mol
nH2SO4 = 0,25 . 0,2 = 0,05 mol
Pt: Na2O + H2O --> 2NaOH
.....0,055<-----------(0,01 + 0,1)....(mol)
.....NaOH + HCl --> NaCl + H2O
....0,01<----0,01..............................(mol)
.....2NaOH + H2SO4 --> Na2SO4 + 2H2O
......0,1<------0,05............................................(mol)
mNaOH = 0,055 . 40 = 2,2 (g)
Đúng 0
Bình luận (1)
Bài 2:
nH2SO4 = 1,1 . 0,1 = 0,11 mol
nNaOH = 1 . 0,1 = 0,1 mol
nAl = \(\dfrac{1,35}{27}=0,05\left(mol\right)\)
Pt: 2NaOH + H2SO4 --> Na2SO4 + 2H2O
.....0,05 mol-> 0,1 mol
Xét tỉ lệ mol giữa NaOH và H2SO4:
\(\dfrac{0,1}{2}< \dfrac{0,11}{1}\)
Vậy H2SO4 dư
nH2SO4 dư = 0,11 - 0,1 = 0,01 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
................0,01 mol-------------------> 0,01 mol
Xét tỉ lệ mol giữa Al và H2SO4:
\(\dfrac{0,05}{2}>\dfrac{0,01}{3}\)
Vậy Al dư
VH2 thu được = 0,01 . 22,4 = 2,24 (lít)
Đúng 0
Bình luận (0)
https://i.imgur.com/57zh0pd.jpg
Cho 100ml dung dịch NaOH (1,5M) tác dụng với 100ml dung dịch H\(H_3PO_4\)(1M). a, viết phương trình phản ứng
b, tính khối lượng muối tạo thành
c, Tính nồng độ mol trên lít sau phản ứng
Mọi người giúp emmm với (đề thi học kỳ đấy ạ)😢
a) nNaOH= 0,15(mol) ; nH3PO4= 0,1(mol)
Ta có: 1< 0,15/0,1 <2
=> Sản phẩm thu được là hỗn hợp 2 muối: NaH2PO4 và Na2HPO4
a) PTHH: NaOH + H3PO4 -> NaH2PO4 + H2O
x____________x__________x(mol)
2 NaOH + H3PO4 -> Na2HPO4 + 2 H2O
y_______0,5y_________0,5y(mol)
b) Ta có hpt:
\(\left\{{}\begin{matrix}x+y=0,15\\x+0,5y=0,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
=> m(muối)=mNaH2PO4 + mNa2HPO4= 120.0,05+142.0,1.0,5=13,1(g)
c) Vddmuoi= VddNaOH+ VddH3PO4= 0,1+0,1=0,2(l)
=> CMddNaH2PO4= 0,05/0,2=0,25(M)
CMddNa2HPO4=(0,1.0,5)/0,2=0,25(M)
Đúng 1
Bình luận (0)
Hợp chất X chứa (C,H,O) có 5 liên kết pi trong phân tử, X tác dụng với NaOH theo tỉ lệ 1 : 3. Đốt cháy hoàn toàn 13,8 gam X cần dùng vừa đủ 15,68 lít khí O2 (đktc), sau phản ứng thu được 5,4 gam nước. Mặt khác, thủy phân hoàn toàn 6,9 gam X trong 100ml dung dịch NaOH 2M thu được dung dịch A. Cô cạn dung dịch A thu được khối lượng chất rắn là A. 11,1 gam B. 13,1 gam C. 9,4 gam D. 14,0 gam
Đọc tiếp
Hợp chất X chứa (C,H,O) có 5 liên kết pi trong phân tử, X tác dụng với NaOH theo tỉ lệ 1 : 3. Đốt cháy hoàn toàn 13,8 gam X cần dùng vừa đủ 15,68 lít khí O2 (đktc), sau phản ứng thu được 5,4 gam nước. Mặt khác, thủy phân hoàn toàn 6,9 gam X trong 100ml dung dịch NaOH 2M thu được dung dịch A. Cô cạn dung dịch A thu được khối lượng chất rắn là
A. 11,1 gam
B. 13,1 gam
C. 9,4 gam
D. 14,0 gam
Bảo toàn khối lượng: mX + mO2 = mCO2 + mH2O
→ 13,8 + 0,7.32 = mCO2 + 5,4 → mCO2 = 30,8 g →nCO2 = 30,8/44 = 0,7 mol
Bảo toàn nguyên tố oxi:
nO(X) + 2nO2 = 2nCO2 + nH2O → nO(X) + 2.0,7 = 2.0,7 + 0,3 → nO(X) = 0,3 mol
Gọi công thức của X là
Ta có: x:y:z = 0,7 : 0,6 : 0,3 = 7 : 6 : 3
→ Công thức đơn giản nhất của X là C7H6O3
→ Công thức phân tử của X là (C7H6O3)n
Vì X có 5 liên kết p trong phân tử nên k = (2.7n + 2 - 6n)/2 = 5 → 4n + 1 = 5 → n =1
→ Công thức phân tử của X là C7H6O3
Vì X phản ứng với NaOH theo tỉ lệ 1: 3
→ Công thức cấu tạo của X là HCOOC6H4OH
Thí nghiệm 2: 6,9 gam X tác dụng với 0,2 mol NaOH: nX = 6,9/138 = 0,05 mol
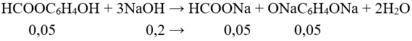
→ Chất rắn gồm: HCOONa: 0,05 mol; NaOC6H4ONa: 0,05 mol và NaOH: 0,2–0,05.3 =0,05 mol
→ mrắn = 0,05.68 + 154.0,05 + 40.0,05 = 13,1 g
→ Đáp án B
Đúng 0
Bình luận (0)
Bài tập về kim loại kiềm và nhôm tác dụng với H2O
Đem hòa tan x gam Na vào 200ml dung dịch Ba(OH)2 0,1M thu được dung dịch A. Cho từ từ dung dịch A vào 100ml dung dịch Al2(SO4)3 0,1M thu được y gam kết tủa. Tìm trih số của x để y có trị số lớn nhất.
Na + H2O → NaOH + 1/2 H2
x/23..........................x/23........x/46 (mol)
nBa(OH)2 = 0,02 (mol)
Dung dịch A có x/23 (mol) NaOH và 0,02 (mol) Ba(OH)2
nAl2(SO4)3 = \(\frac{100\cdot0,1}{1000}\) = 0,01 (mol)
y max => baso pư vừa đủ
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
(mol) x/23..............x/ 138.................x/69........................3x/23
3 Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓
(mol) 0,02....................0,02/3
Theo đề ta có : \(\frac{x}{138}\) + \(\frac{0,02}{3}\) = 0,01
<=> x = 0,52 (gam)
Vậy để y có trị số lớn nhất thì x = 0,52 gam
Đúng 0
Bình luận (2)
Đặt :
nNa= a mol
Na + H2O --> NaOH + 1/2H2
a_____________a
dd A: a mol NaOH , 0.02 mol Ba(OH)2
nAl2(SO4)3 = 0.1*0.1 = 0.01 mol
Cho A vào dd Al2(SO4)3 :
6NaOH + Al2(SO4)3 --> 3Na2SO4 + 2Al(OH)3
a__________a/6
3Ba(OH)2 + Al2(SO4)3 --> 3BaSO4 + 2Al(OH)3
0.02_________1/150
Để lượng kết tủa lớn nhất thì : OH- và Al2(SO4)3 đủ
<=> nAl2(SO4)3 = 0.01
<=> a/6 + 1/150 = 0.01
<=> a = 0.02
mNa = 0.02 * 23 = 0.46 g
Cù Văn Thái
Đúng 0
Bình luận (5)
câu 1 : Trung hòa 200 ml dung dịch H2SO4 1M bằng 200 gam dung dịch NaOH 10% . Dung dịch sau phản ứng làm quỳ tím chuyển sang :
A. Đỏ C. Xanh
B. Vàng Nhạt D. Không màu
câu 2 : Dung dịch A có pH 7 và tạo kết tủa khi tác dụng với dung dịch Ba(NO3)2 . Chất A là :
A. HCl...
Đọc tiếp
câu 1 : Trung hòa 200 ml dung dịch H2SO4 1M bằng 200 gam dung dịch NaOH 10% . Dung dịch sau phản ứng làm quỳ tím chuyển sang :
A. Đỏ C. Xanh
B. Vàng Nhạt D. Không màu
câu 2 : Dung dịch A có pH < 7 và tạo kết tủa khi tác dụng với dung dịch Ba(NO3)2 . Chất A là :
A. HCl C. H2SO4
B. Na2SO4 D. Ca(OH)2
câu 3 : Thuốc thử dùng để nhận biết : HNO3 ; Ba(OH)2 ; NaCl ; NaNO3 đựng riêng biệt trong các lọ mất dãn là :
A. Dùng quỳ tím và dung dịch Ba(NO3)2
B. Dùng dung dịch Phenolphatalein và dung dịch AgNO3
C. Dùng quỳ tím và dung dịch AgNO3
D. Dùng dung dịch phenolphatalein và dung dịch Ba(NO3)2
câu 4 : dùng thuốc thử sau đây để nhận biết các chất chứ trong các ống nghiệm mất nhãn : HCl ; KOH ; NaNO3 ; NaSO4 ; Na2SO4
A. Dùng quỳ tím và dung dịch CuSO4
B. Dùng dung dịch phenolphatalein và dung dịch BaCl2
C. Dùng qỳ tím và dung dịch BaCl2
D. Dùng dung dịch phenolphatalein và dung dịch H2SO4
câu 5 : cho 0,2 mol Cao tác dụng với 500ml dung dịch HCl 1M . Khối lượng muối thu được là :
A. 2,22 g B. 22,2 g C. 23,2g D. 22,3 g
câu 6 : hòa tan 16 gam SO3 trong nước thu được 250 ml dung dịch axit . nồng độ của dung dịch thu được :
A. 0,2M B. 0,4M C. 0,6M D. 0,8M
câu 7 : khi cho 500 ml dung dịch NaOH 1M tác dụng hết với dung dịch H2SO4 2M tạo thành muối trung hòa . Thể tích dung dịch H2SO4 2M :
A. 250ml B. 400ml C. 500ml D. 125ml
câu 8 : cho 10,5gam hỗn hợp hai kim loại Zn và Cu vào dung dịch H2SO4 loãng dư , người ta thu được 2,24 lít khí (đktc) . Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu :
A. 61,9% và 38,15
B. 63% và 37%
C. 61,5% và 38,5%
D. 65% và 35%
câu 9 : hòa tan hết 4,6 gam Na và H2O được dung dịch X . Thể tích dung dịch HCl 1M cần để phản ứng hết với dung dịch X là :
A. 100ml B. 200ml C. 300ml D. 400ml
câu 10 : trung hòa 200ml dung dịch H2SO4 1M bằng dung dịch NaOH 20% . Khối lượng dung dịch NaOh cần dùng :
A. 100g B. 80g C. 90g D. 150g
câu 11 : để trung hòa 112gam dung dịch KOH 25% thì cần bao nhiêu gam dung dịch axit sunfuric 4,9%
A. 400g B. 500g C. 420g D. 570g
câu 12 : cho 100ml dung dịch H2SO4 2M tác dụng với 100ml dung dịch Ba(NO3)2 1M . Nồng độ mol của dung dịch sau phản ứng lần lượt là :
A. H2SO4 1M và HNO3 0,5M
B. BaSO4 0,5M và HNO3 1M
C. HNO3 0,5M và Ba(NO3)2 0,5M
D. H2SO4 0,5M và HNO3 1M
câu 13: hòa tan vừa hết 20g hỗn hợp CuO và Fe2O3 trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp :
A. 4g và 16g B. 10g và 10g
C. 8g và 12g D. 14g và 6g
Câu 2c: pH<7 môi trường axit và tạo kết tủa với Ba(NO3)2 nên là H2SO4 đáp án C
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 100ml dd H2SO4 2M tác dụng với 100ml dd Ba(NO3)2 1M. Tính nồng độ mol của dung dịch sau phản ứng.
\(n_{H_2SO_4}=0,1.2=0,2mol\)
\(n_{Ba\left(NO_3\right)_2}=0,1.1=0,1mol\)
PTPU
\(Ba\left(NO_3\right)_2+H_2SO_4->BaSO_4+2HNO_3\)
0,1.....................0,1...................0,1..............0,2(mol)
n\(_{BaSO_4}\)=0,1mol
C\(_{M_{BasO_4}}\)=0,1/0,2=0,5M
n\(_{H_2SO_{4_{dư}}}\)=0,1mol
C\(_{M_{H_2SO_{4_{dư}}}}\)=0,1/0,2=0,5M
Đúng 1
Bình luận (0)
Hỗn hợp A gồm Al(OH)3 và Zn(OH)2. Hòa tan m (g) A vào 180ml dd HCl 1M vừa đủ, mặt khác m (g) A lại tác dụng với 100ml dd KOH 1M vừa đủ. Tính % khối lượng mỗi chất trong A?
- Đặt nAl(OH)3 = x mol và nZn(OH)2 = y mol
- Hòa tan m (g) A vào 180ml dd HCl 1M vừa đủ
nHCl = 0,18 mol
Al(OH)3 (x) + 3HCl (3x) -----> AlCl3 + 3H2O (1)
Zn(OH)2 (y) + 2HCl (2y) -----> ZnCl3 + 2H2O (2)
- Theo PTHH(1;2): nHCl = 3x + 2y = 0,18 mol
- mặt khác m (g) A lại tác dụng với 100ml dd KOH 1M vừa đủ.
nKOH = 0,1 mol
Al(OH)3 (0,1) + KOH (0,1) -----> KAlO2 + 2H2O (3)
- Theo PTHH(3): nAl(OH)3 = x = 0,1 mol
- Thay x = 0,1 vào 3x + 2y = 0,18
=> y =
P/S: chà ko biết sai chỗ nào nữa, hay đề lộn vậy ta
Đúng 0
Bình luận (1)






















