Cho các phản ứng sau :
(a) H2S + SO2 ®
(b) Na2S2O3 + dung dịch
(c) SiO2 + Mg → tỉ lệ mol 1 : 2 , t °
(d) Al2O3 + dung dịch
(e) Ag + O3 ®
(g) SiO2 + dung dịch HF →
Số phản ứng tạo ra đơn chất là
A. 4.
B. 5.
C. 6
D. 3.
Cho các phản ứng sau :
(a) H2S + SO2 ®
(b) Na2S2O3 + dung dịch H2SO4 (loãng) ®
(c) SiO2 + Mg → t ỉ l ệ m o l 1 : 2 t ∘
(d) Al2O3 + dung dịch NaOH ®
(e) Ag + O3 ®
(g) SiO2 + dung dịch HF ®
Số phản ứng tạo ra đơn chất là
A. 4
B. 5
C. 6
D. 3
Cho các phản ứng sau :
(a) H2S + SO2 ®
(b) Cu + dung dịch H2SO4 (loãng) ®
(c) SiO2 + Mg → t ỉ l ệ m o l 1 : 2 t o
(d) Al2O3 + dung dịch NaOH ®
(e) H2S + FeCl3®
(g) C + H 2 O h ơ i → t o
Số phản ứng tạo ra đơn chất là
A. 4.
B. 5.
C. 6.
D. 3.
Đáp án A
(a) H2S + SO2 ®
(c) SiO2 + Mg → t ỉ l ệ m o l 1 : 2 t o
(e) H2S + FeCl3®
(g) C + H 2 O h ơ i → t o
Cho các thí nghiệm sau:
(a) Cho dung dịch Na2S2O3 vào dung dịch H2SO4 loãng.
(b) Cho dung dịch NH4Cl tác dụng với dung dịch NaNO2 đun nóng.
(c) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(d) Cho khí SO2 tác dụng với khí H2S.
(e) Cho Si đơn chất tác dụng với dung dịch NaOH.
(f) Cho khí O3 tác dụng với Ag.
(g) Nung SiO2 và Mg (tỉ lệ mol 1:2) trong điều kiện không có không khí.
(h) Đốt khí H2S trong O2 dư.
Số thí nghiệm tạo ra đơn chất là
A. 7
B. 5
C. 6
D. 8
Đáp án : A
(a) S
(b) N2
(c) Cl2
(d) S
(e) H2
(f) O2
(g) Si
Thực hiện các thí nghiệm sau:(1) Cho dung dịch H2O2 vào dung dịch KI(2) Cho dung dịch Na2S2O3 vào dung dịch H2SO4 loãng(3) Sục khí SO2 vào dung dịch H2S(4) Đun nóng hỗn hợp SiO2 và Mg(5) Sục khí O3 vào dung dịch KI(6) Sục khí H2S vào dung dịch FeCl3(7) Đốt cháy Ag2S trong O2
Số thí nghiệm có thể tạo ra đơn chất là
Mình cần đán án thoy ko cần lời giải đâu nha, trắc nghiệm á
cả 7 thí nghiệm đều có thể phản ứng tạo ra đơn chất.
Cho các phản ứng sau:
(a) SiO2 + dung dịch HF ®
(b) Si + dung dịch NaOH ®
(c) FeO + Co → t o
(d) O3 + KI + H2O ®
(e) C u N O 3 3 → t o
(g) K M n O 4 → t o
Số phản ứng sinh ra đơn chất là
A. 4.
B. 6.
C. 5.
D. 3.
Cho các phản ứng:
(1) O3 + dung dịch KI (6) F2 + H2O
(2) MnO2 + HCl đặc (7) H2S + dung dịch Cl2
(3) KClO3 + HCl đặc (8) HF + SiO2
(4) NH4HCO3 (9) NH4Cl + NaNO2
(5) Na2S2O3 + H2SO4 đặc (10) Cu2S + Cu2O
A. 7
B. 9
C. 6
D. 8
Chọn đáp án C
(1) O3 + dung dịch KI → I2 (6) F2 + H2O → t o O2
(2) MnO2 + HCl đặc → t o Cl2 (3) KClO3 + HCl đặc → t o Cl2
(9) NH4Cl + NaNO2 → t o N2 (10) Cu2S + Cu2O → Cu
Chú ý: (5) Na2S2O3 + H2SO4 đặc → t o S → SO2
Thực hiện các thí nghiệm sau:
(a) Sục khí S O 2 vào dung dịch B r 2 .
(b) Sục khí S O 2 vào dung dịch H 2 S .
(c) Cho Cu vào dung dịch H 2 S O 4 đặc, nóng.
(d) Cho M n O 2 vào dung dịch HCl đặc, nóng.
(e) Cho F e 2 O 3 vào dung dịch H 2 S O 4 đặc, nóng.
(f) Cho S i O 2 vào dung dịch HF.
Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
A. 3
B. 6
C. 4
D. 5
Chọn C
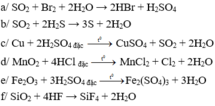
→ Các phản ứng a, b, c và d thuộc phản ứng oxi hóa – khử
Cho các chất sau: CO, CO2, SO2, NO, NO2, Cl2, SiO2, H2S, NH3. Lần lượt dẫn chúng qua dung dịch Ba(OH)2 thì xảy ra bao nhiêu phản ứng và bao nhiêu phản ứng oxi hóa khử?
A. 5 phản ứng và 2 phản ứng oxi hóa khử
B. 6 phản ứng và 3 phản ứng oxi hóa khử
C. 4 phản ứng và không có phản ứng oxi hóa khử
D. 6 phản ứng và 2 phản ứng oxi hóa khử
Đáp án A
Các phản ứng xảy ra là:
CO2+ Ba(OH)2 → BaCO3+ H2O (1)
SO2+ Ba(OH)2 → BaSO3+ H2O (2)
4NO2+2 Ba(OH)2 → Ba(NO3)2+ Ba(NO2)2+ 2H2O (3)
2Cl2+2 Ba(OH)2 → BaCl2+ Ba(ClO)2+ 2H2O (4)
H2S+ Ba(OH)2 → BaS + 2H2O (5)
Có 5 phản ứng xảy ra, trong đó phản ứng 3 và 4 là phản ứng oxi hóa khử
Chú ý SiO2 chỉ tan trong kiềm đặc nóng.
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2)Cho H2S vào dd axit sunfurơ.
(3) Cho khí O3 tác dụng với dung dịch KI.
(4) Cho CaOCl2 tác dụng với HCl đặc.
(5) Cho F2 tác dụng với nước.
(6) Cho khí O3 tác dụng với Ag.
(7) Cho khí Na2S2O3 tác dụng với dung dịch H2SO4.
(8) Đun nóng SiO2 và Mg.
(9) Đun nóng CO2 và Mg.
(10) Đun nóng hh (H2SO4 đặc + MnO2 ; NaCl).
(11) Đun nóng SO2 và Mg.
(12) Cho KI tác dụng với và H2O2.
(13) Cho H2O2 tác dụng với hốn hợp KMnO4 vàH2SO4.
Số thí nghiệm tạo ra đơn chất là :
A. 11
B. 9
C. 12
D. 10
Đáp án : C
Các thí nghiệm là : (2)-S ; (3)-O2 ; (4)-Cl2 ; (5)-O2 ; (6)-O2 ; (7)-S; (8)-Si ; (9)-C ; (10) – Cl2 ;(11)-S ; (12)-I2 ; (13)-O2