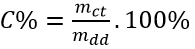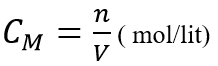Em hãy tóm tắt tính chất lí học, hóa học, sinh học của nước nuôi thủy sản.

Những câu hỏi liên quan
Em hãy nêu tóm tắt chất lí học, hóa học, sinh học của nước nuôi thủy sản
– Tính chất lí học: nhiệt độ, màu sắc, độ trong và sự chuyển động của nước.
– Tính chất hóa học gồm: các chất khí hòa tan, các muối hòa tan và độ pH.
– Tính chất sinh học: trong các vùng nước nuôi thủy sản có nhiều sinh vật sống như thực vật thủy sinh, động vật phù du và các loại động vật đáy
Đúng 1
Bình luận (0)
– Tính chất lí học: nhiệt độ, màu sắc, độ trong và sự chuyển động của nước.
– Tính chất hóa học gồm: các chất khí hòa tan, các muối hòa tan và độ pH.
– Tính chất sinh học: trong các vùng nước nuôi thủy sản có nhiều sinh vật sống như thực vật thủy sinh, động vật phù du và các loại động vật đáy
Đúng 2
Bình luận (0)
– Tính chất lí học: nhiệt độ, màu sắc, độ trong và sự chuyển động của nước.
– Tính chất hóa học gồm: các chất khí hòa tan, các muối hòa tan và độ pH.
– Tính chất sinh học: trong các vùng nước nuôi thủy sản có nhiều sinh vật sống như thực vật thủy sinh, động vật phù du và các loại động vật đáy
Đúng 1
Bình luận (0)
Em hay nêu tóm tắt tính chất lý học của nước nuôi thuỷ sản?
- Nhiệt độ: Nhiệt độ có ảnh hưởng đến tiêu hóa, hô hấp và sinh sản của tôm cá.
- Độ trong: Độ trong là tiêu chí đánh giá độ tốt, xấu của nước nuôi thủy sản, là biểu thị mức độ ánh sáng xuyên qua mặt nước.
- Màu nước: Nước có 3 màu màu nõn chuối hoặc vàng lục, màu tro đục, xanh đồng, màu đen, mùi thối.
- Sự chuyển động của nước: Có 3 hình thức chuyển động : sóng, đối lưu, dòng chảy.
Đúng 0
Bình luận (0)
nước nuôi thủy sản có những tính chất hóa học nào
Tham khảo :
Nước nuôi thủy sản có những tính chất hóa học sau:
- Các chất khí hòa tan (Khí oxi, cacbobnic).
- Các muối hòa tan (Đạm nitrat, lân, sắt,…).
- Độ pH (độ pH từ 6 – 9 là phù hợp).
ĐỀ CƯƠNG ÔN TẬP HỌC KÌ II MÔN HÓA HỌC LỚP 8Hoàn thành đề cương ra giấy ghi rõ họ tên để đi học trở lại cô sẽ thu chấm điểm các em nhé.PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢNA. CHƯƠNG 4: OXI-KHÔNG KHÍI. TÍNH CHẤT CỦA OXI1. Tính chất vật lí2. Tính chất hóa học: Viết PT minh họa cho mỗi t/cII. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI1. Sự oxi hóa là gì?2. Phản ứng hóa hợp là gì?III. OXIT1. Định nghĩa ; cho vd 2. Phân loại: cho vd3. Cách gọi tên: cho vd ...
Đọc tiếp
ĐỀ CƯƠNG ÔN TẬP HỌC KÌ II MÔN HÓA HỌC LỚP 8
Hoàn thành đề cương ra giấy ghi rõ họ tên để đi học trở lại cô sẽ thu chấm điểm các em nhé.
PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢN
A. CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. Tính chất vật lí
2. Tính chất hóa học: Viết PT minh họa cho mỗi t/c
II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI
1. Sự oxi hóa là gì?
2. Phản ứng hóa hợp là gì?
III. OXIT
1. Định nghĩa ; cho vd 2. Phân loại: cho vd
3. Cách gọi tên: cho vd 4. công thức ?
3. Cách gọi tên: cho vd 4. công thức ?
IV. Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi Trong phòng thí nghiệm. viết PT minh họa
2. Phản ứng phân hủy là gì? Cho vd
V. KHÔNG KHÍ - SỰ CHÁY
1. Thành phần của Không khí2. Sự cháy và sự oxi hóa chậm
B. CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro 1. Tính chất vật lý 2. Tính chất hóa học: viết PT minh họa
II. Điều chế khí Hiđrơ - Phản ứng thế
1. Điều chế hidrô Trong phòng thí nghiệm 2. Phản ứng thế
III. Nước 1. Tính chất vật lý 2. Tính chất hóa học
IV. Axit - Bazơ - Muối
Nêu khái niệm, CTHH; phân loại; cách gọi tên các hợp chất và cho vd
C. CHƯƠNG 6: DUNG DỊCH
I. Dung môi – chất tan – dung dịch
II. Dung dịch chưa bão hòa. Dung dịch bão hòa
III. Độ tan của một chất trong nước Khái niệm; Công thức tính:
IV. NỒNG ĐỘ DUNG DỊCH
1. Nồng độ phần trăm: Khái niệm; Công thức tính:
2. Nồng độ mol dung dich: Khái niệm; Công thức tính:
PHẦN 2. BÀI TẬP
A. TRẮC NGHIỆM
Khoanh tròn vào một chữ cái A, B, C hoặc D đứng trước phương án chọn đúng:
1. Oxit là: A. Hợp chất của oxi với 1 nguyên tố khác
B. Hợp chất gồm 2 nguyên tố, trong đó có 1 nguyên tố là oxi.
C. Hợp chất được tạo bởi nguyên tố oxi và 1 nguyên tố nào đó.
D. Cả A, B, C đúng.
2. Oxit axit là: A. Là oxit của phi kim và tương ứng với 1 axit
B. Là oxit của kim loại và tương ứng với 1 axit
C. Là oxit của phi kim và tương ứng với 1 oxit axit
D. Thường là oxit của phi kim và tương ứng với 1 axit
3. Oxit bazơ là: A. Là oxit của phi kim và kim loại, tương ứng với 1 bazơ
B. Là oxit của kim loại và tương ứng với 1 bazơ
C. Thường là oxit của phi kim và tương ứng với 1 bazơ
D. Là oxit của phi kim và tương ứng với 1 oxit axit
4. Cho các oxit sau: SO2, SO3, Fe2O3, P2O5, K2O, NO, CO. Trong đó có mấy oxit axit
A. 4 B. 2 C. 3 D. 1
5. Cho các oxit sau: BaO, SO3, FeO, P2O5, Na2O. Trong đó có mấy oxit bazo
A. 1 B. 3 C. 2 D. 4
6. Cho các oxit có công thức hóa học sau:
CO2; NO; BaO; P2O5 ; NO2; K2O; ZnO; N2O5 ; Al2O3
a) Các oxit axit được sắp xếp như sau:
A. CO2; NO; NO2; K2O B. NO; BaO; P2O5; N2O5
C. CO2 ; P2O5 ; NO2 ; N2O5 D. BaO; P2O5; K2O; Al2O3
b) Các oxit bazơ được sắp xếp như sau:
A. BaO ; K2O; ZnO ; N2O5 B. BaO ; ZnO ; K2O ; Al2O3
C. BaO; P2O5; K2O; Al2O3 D. ZnO; N2O5; K2O; Al2O3
7. Trong các oxít sau đây, oxít nào tác dụng được với nước
A. SO3, CuO, K2O B. SO3 , K2O, CO2, BaO C. SO3, Al2O3, K2O D. N2O5, K2O, ZnO
8. Trong những chất sau đây, chất nào là axít
A. H2SiO3, H2SO4, Cu(OH)2, K2SiO3 B. HNO3, Al2O3, NaHSO4, Ca(OH)2
C. H3PO4, HNO3, H2S D. H2S, Al2O3, H2SO4, Ca(OH)2
9. Hợp chất nào dưới đây là các bazơ tan trong nước:
A. Mg(OH)2; Ba(OH)2; Al(OH)3 B. NaOH; KOH ; Ca(OH)2
C. NaOH; Cu(OH)2; AgOH D. KOH; Zn(OH)2; NaOH
10. Dãy hợp chất gồm các bazơ đều không tan trong nước:
A. Mg(OH)2; Cu(OH)2 ; Fe(OH)3 B. NaOH ; KOH ; Ca(OH)2
C. NaOH; Fe(OH)2; LiOH D. Al(OH)3; Zn(OH)2; Ca(OH)2.
11. Dung dịch làm quỳ tím hóa đỏ là:
A. H2O B. Dung dịch NaOH C. Dung dịch H2SO4 D. Dung dịch K2SO4
12. Có thể phân biệt các dung dịch axit, muối ăn, kiềm bằng cách dùng:
A. Nước cất B. Giấy quỳ tím C. Giấy phenolphtalein D. Khí CO2
13. Có những chất rắn sau: FeO, P2O5, Ba(OH)2, NaNO3. Thuốc thử được chọn để phân biệt các chất trên là:
A. dung dịch H2SO4, giấy quỳ tím. B. H2O, giấy quỳ tím.
C. dung dịch NaOH, giấy quỳ tím. D. dung dịch HCl, giấy quỳ.
14. Dãy chất nào sau đây gồm toàn muối:
A. KCl, HNO3, FeCl2, NaHCO3 B. NaNO3, Al2(SO4)3, NaOH, H2SO4
C. ZnCl2, Mg(NO3)2, KCl, H2S D. Mg(NO3)2, ZnCl2, FeCl2, AgCl.
15. Cho biết phát biểu nào dưới đây là đúng:
A. Gốc cacbonat (CO3) và sunfat (SO4) hoá trị III B. Gốc photphat (PO4) hoá trị II
C. Gốc Clorua (Cl) và Nitrat (NO3) hoá trị I D. Nhóm hiđroxit (OH) hoá trị II
16. Từ công thức hoá học Fe2O3 và H2SO4, công thức tạo bởi Fe và SO4 là:
A. FeSO4 B. Fe2(SO4)3 C. Fe(SO4)3 D. Fe3(SO4)2
17. Cho các phương trình phản ứng sau:
1. Zn + 2HCl →ZnCl2 + H2 2. 2H2O →2H2 + O2
3. 2Al + 3H2SO4 →Al2( SO4)3 + 3H2 4. 2Mg + O2 →2MgO
5. 2KClO3 →2KCl + 3O2 6. H2 + CuO →Cu + H2O 7. 2H2 + O2 →2H2O
a. Phản ứng hoá hợp là: A. 1, 3 B. 2, 5 C. 4,7 D. 3, 6
b. Phản ứng phân huỷ là: A. 5, 6 B. 2 , 5 C. 4, 5 D. 2, 7
c. Phản ứng thế là: A. 1, 3, 6 B. 1, 3, 7 C. 3, 5, 6 D. 4, 6, 7.
18. Cặp chất nào sau đây dùng để điều chế oxi trong phòng thí nghiệm:
A. H2O, KClO3 B. KMnO4, CaCO3 C. KClO3, KMnO4 D. HCl, Mg
19. Cho các khí: CO, N2, O2, Cl2, H2 .Các khí nhẹ hơn không khí là:
A. N2, H2, CO B. N2, O2, Cl2 C. CO, Cl2 D. Cl2, O2
20. Ứng dụng của hiđro là:
A. Dùng làm nguyên liệu cho động cơ xe lửa
B. Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng
C. Dùng để bơm vào khinh khí cầu D. Dùng để khử trùng sát khuẩn
21. Trong phòng thí nghiệm người ta điều chế hidro bằng cách nào dưới đây:
A. Cho Zn tác dụng với dd HCl B. Điện phân nước
C. Cho K tác dụng với nước D. Cho Zn tác dụng với dd H2SO4 đặc nóng
22. Sự oxi hóa là:
A. Sự tác dụng của oxi với 1 kim loại. B. Sự tác dụng của oxi với 1 phi kim.
C. Sự tác dụng của oxi với 1 chất. D. Sự tác dụng của oxi với 1 nguyên tố hoá học.
23. Sự oxi hóa chậm là:
A. Sự oxi hóa mà không tỏa nhiệt B. Sự oxi hóa mà không phát sáng
C. Sự oxi hóa toả nhiệt mà không phát sáng D. Sự tự bốc cháy
24. Nước là hợp chất mà phân tử được tạo bởi:
A. một nguyên tử H và một nguyên tử O B. hai nguyên tử H và một nguyên tử C. hai nguyên tử H và hai nguyên tử O D. một nguyên tử H và hai nguyên tử O.
25. Để tổng hợp nước người ta đã đốt cháy hoàn toàn 2,24 lít khí hiđro ( đktc) trong oxi. Thể tích khí oxi cần dùng là:
A. 1,12 lit B. 2,24 lit C. 22,4 lit D. 11,2 lit
26. Cho H2O tác dụng vừa đủ với Na. Sản phẩm tạo ra là:
A. Na2O B. NaOH và H2 C. NaOH D. Không có phản ứng.
27. Dung dịch là hỗn hợp:
A. Của chất khí trong chất lỏng B. Của chất rắn trong chất lỏng
C. Đồng nhất của chất lỏng và dung môi D. Đồng nhất của dung môi và chất tan.
28. Khi hoà tan 100ml rượu etylic vào 50ml nước thì:
A. Rượu là chất tan và nước là dung môi B. Nước là chất tan và rượu là dung môi
C. Nước và rượu đều là chất tan D. Nước và rượu đều là dung môi
29. Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
A. Tăng B. Giảm C. Có thể tăng hoặc giảm D. Không thay đổi
30. Trong thí nghiệm cho từ từ 2 muỗng đường vào nước. Dung dịch đường này có thể hòa tan thêm đường,
A. Dung dịch đường bão hòa B. Dung dịch đường chưa bão hòa
C. Dung dịch đồng nhất D. Cả A, B, C đều đúng
B. TỰ LUẬN
1. Hoàn thành các phản ứng hóa học sau và cho biết phản ứng nào là: phản ứng hóa hợp, phản ứng cháy, phản ứng phân hủy, phản ứng thế
a/ ……….+……… →ZnO b/ ………+ ……… →H3PO4
c/ ………+ ……… →CO2 + H2O d/ ………+ ……… →K2S
e/ H2O →……… + ……… f/ KClO3 →……… + ………
g/ ……… +……… →CuCl2 h/ KMnO4 ![]() ……… + ……… + ……….
……… + ……… + ……….
i/ Zn + HCl →……… +……… j/ Al + H2SO4 →……… + ………
k/ H2 + ……… →Cu + ……… l/ CaO + H2O →……
2. Nhiệt phân hoàn toàn 24,5g KClO3. Tính thể tích khí O2 (ở đktc) thu được?
3. Muốn điều chế được 5,6 lít O2 (ở đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu?
4. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Để điều chế được 2,32g Fe3O4 cần dùng:
a) Bao nhiêu gam sắt? b) Bao nhiêu lít khí O2 (ở đktc)?
5. Đốt cháy hoàn toàn 2,7g nhôm. Tính :
a) Thể tích khí O2 (đktc) cần dùng?
b) Số gam KMnO4 cần dùng để điều chế lượng khí O2 trên?
7. Xác định công thức hóa học của nhôm oxit, biết tỉ lệ khối lượng của 2 nguyên tố nhôm và oxi bằng 9 : 8.
8. Một oxit của lưu huỳnh trong đó oxi chiếm 60% về khối lượng. Tìm công thức phân tử của oxit đó?
9. Cho 11,2 g sắt vào 200 ml dung dịch H2SO4 2M. Hãy:
a) Tính lượng khí H2 tạo ra ở đktc?
b) Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu?
c) Tính nồng độ các chất sau phản ứng?
10. Cho 28,4g điphotpho pentaoxit P2O5 vào cốc chứa 90g nước để tạo thành axit photphoric. Tinh khối lượng axit H3PO4 được tạo thành ?
11. Gọi tên, phân loại các chất sau: Ca(OH)2, NaOH, KOH, Mg(OH)2, HNO3, H2SO4, HCl, H3PO4, NaCl, FeO, CuO, K2SO4, Na3PO4, AgNO3, CaSO4, NaHCO3, MgO, NaHSO4, Ca(HCO3)2, NaH2PO4
Lần sau đăng câu hỏi chia nhỏ ra nhé em !
PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢN
A. CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. Tính chất vật lí
- Là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí
- Oxi hóa lỏng ở -183°C
- Oxi lỏng có màu xanh nhạt
2. Tính chất hóa học: Viết PT minh họa cho mỗi t/c
a. Tác dụng với phi kim
PTHH: S + O2 ----to-----> SO2
PTHH: 4P + 5O2 ----to-----> 2P2O5
b. Tác dụng với kim loại
PTHH: 3Fe + 2O2 ----to-----> Fe3O4
c. Tác dụng với hợp chất:
CH4 + 2O2 ----to-----> CO2 + H2O
II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI
1. Sự oxi hóa là gì?
Là sự tác dụng của oxi với một chất
2. Phản ứng hóa hợp là gì?
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Phản ứng cần nâng nhiệt độ lên để khơi mào phản ứng lúc đầu, các chất sẽ cháy, tỏa nhiều nhiệt gọi là phản ứng tỏa nhiệt.
III. OXIT
1. Định nghĩa
Oxit là hợp chất của ha nguyên tố , trong đó có một nguyên tố là oxi
VD: sắt từ oxi Fe3O4, lưu huỳnh đioxi SO2,…
2. Phân loại:
a. Oxit axit:
Thường là oxit của phi kim và tương ứng với một axit
Vd : SO3 tương ứng với axit H2SO4
CO2 tướng ứng với axit H2CO3
b. Oxit bazo
Thường là oxit của kim loại và tương ứng với một bazơ
VD: MgO tương ứng với bazo Mg(OH)2
K2O tương ứng với KOH
3. Cách gọi tên:
Tên oxit = tên nguyên tố + oxit
- Nếu kim loại có nhiều hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
VD: FeO : sắt (II) oxit
Fe2O3 : sắt (III) oxit
- Nếu phi kim có nhiều hóa trị
Tên gọi = tên phi kim + oxit
Dùng các tiền tố ( tiếp đầu ngữ) chỉ số nguyên tử
+ Mono: một
+ Đi : hai
+ Tri : ba
+ Tetra : bốn
+ Penta : năm
VD: CO: cacbon monooxit
CO2: cacbon đioxit
SO2: lưu huỳnh đioxit
SO3: lưu huỳnh trioxit
P2O3: điphotpho trioxit
P2O5 : đi photpho pentaoxit
4. công thức :
- CT chung M2Ox với x là hóa trị của chất M
- Nếu x = 2 thì có công thức là MO
Đúng 2
Bình luận (0)
IV. Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi Trong phòng thí nghiệm. viết PT minh họa
Trong phòng thí nghiệm
Đun nóng hợp chất giâu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi thoát ra theo PT:
2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
2. Phản ứng phân hủy là gì? Cho vd
Là phản ứng hóa học trong đó từ môtj chất sinh ra nhiều chất mới.
VD: 2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
V. KHÔNG KHÍ - SỰ CHÁY
1. Thành phần của Không khí
a. Thành phần chính
Không khí là một hỗn hợp khí trong đó oxi chiếm khoảng 1/5 thể tích. Cự thể oxi chiếm 21% thể tích, phần còn lại hầy hết là nitơ
b. Thành phần khác
Các khí khác (hơi nước, CO2, khí hiếm, bụi khói,…) chiếm tỉ lệ rất nhỏ, chỉ khoảng 1%
2. Sự cháy và sự oxi hóa chậm
a. Sự cháy
- Là sự oxi hóa có tỏa nhiệt và phát sáng
- Sự khác nhau giữa sự cháy trong oxi và trong không khí: cháy trong không khí diễn ra chậm hơn, tạo nhiệt độ thấp hơn trong oxi. Do trong không khí còn có nito với thể tích gấp 4 lần oxi, làm diện tích tiếp xúc của vật với oxi ít nên sự cháy diễn ra chậm hơn. Đồng thời, nhiệt tiêu hao còn dùng để đốt nóng khí nitơ nên nhiệt độ đạt được thấp hơn
b. Sự oxi hóa chậm
- Là sự oxi hóa có tỏa nhiệt nhưng không phát sáng
- VD: sắt để lâu trong không khí bị gỉ
- Trong điều kiện nhất định, sựu oxi hóa chậm có thể chuyển thành sự cháy
B. CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro
1. Tính chất vật lý
Là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước
2. Tính chất hóa học: viết PT minh họa
a. Tác dụng với oxi
Nếu đốt cháy hidro trong oxi: hidro cháy mạnh, trên thành lọ xuất hiện những giọt nước nhỏ
PTHH: 2H2 + O2 −to→ 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidro và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với đồng oxit CuO
Khi đốt nóng tới khoảng 400°C : bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
PTHH: H2 + CuO −to→ Cu +H2O
⇒ Hidro đã chiến oxi trong CuO. Vậy hidro có tính khử
⇒ở nhiệt độ thích hợp, hidro có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. do vậy hidro có tính khử. Các phản ứng này đều tỏa nhiệt
II. Điều chế khí Hiđrơ - Phản ứng thế
1. Điều chế hidrô Trong phòng thí nghiệm
Cho kim loại (Al, Fe, ….) tác dụng với dung dịch axit (HCl, H2SO4).
Khí H2 được thư bằng cách đẩy không khí hay đẩy nước. nhận ra khí H2 bằng que đóm đang cháy ( cháy trong không khí với ngộn lửa xanh nhạt) hoặc dùng tàn đóm ( không làm tàn đóm bùng cháy)
VD: Fe + 2HCl → FeCl2 + H2
2. Phản ứng thế
Phản ứng thế là phản ứng hóa học của đơn chất và hợp chất trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất
VD: Fe + 2HCl → FeCl2 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
III. Nước
1. Tính chất vật lý
Là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị
Sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C
Khối lượng riêng ở 4°C là 1 g/ml (hay 1kg/lít)
Có thể hòa tan được nhiều chất rắn ( muối ăn, đường,…), chất lỏng ( còn, axit), chất khí (HCl,…)
2. Tính chất hóa học
Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
IV. Axit - Bazơ - Muối
Nêu khái niệm, CTHH; phân loại; cách gọi tên các hợp chất và cho vd
1. Axit
a. Khái niệm
Phân tử axit gồm có một hay nhiều nguyên tử hihdro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại
b. CTHH: gồm một hay nhiều nguyên tử H và gốc axit
c. Phân loại: 2 loại
- Axit không có oxi: HCl, H2S,….
- Axit có oxi: H2SO4, H2CO3,…
d. Tên gọi
- Axit không có oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Gốc axit tương ứng là clorua
H2S: axit sunfuhidric. Gốc axit tương ứng là sunfua
- Axit có oxi
+ Axit có nhiều oxi:
Tên axit = axit + tên phi kim + ic
VD: H2SO4 : axit sunfuric. Gốc axit: sunfat
HNO3: axit nitric. Gốc axit: nitrat
+ Axit có ít oxi:
Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Gốc axit sunfit
2. Bazơ
a. Khai niệm:
Phân tử bazo gồm có môt nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n , n: số hóa trị của kim loại
c. Tên gọi:
Tên bazo = tên kim loại ( kèm hóa trị nếu có nhiều hóa trị) + hidroxit
VD: Fe(OH)2: sắt (II) hidroxit
KOH: kali hidroxit
d. Phân loại
Bazơ tan trong nước gọi là kiềm. VD: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không tan trong nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối có một hay nhiều nguyên tử kim loại liên kết với môht hay nhiều gốc axit
b. CTHH: gồm 2 phần: kim loại và gốc axit
VD: Na2SO4, CaCO3,…
c. Tên gọi
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4 : natri sunfat
CaCO3: canxi cacbonat
FeSO4: sắt (II) sunfat
d. Phân loại
- Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hidro có thể thay thế bằng các nguyên tử kim loại
VD: Na2SO4, CaCO3,…
- Muối axit: là muối trong đó gốc axit còn nguyên tử hidro H chưa được thay thế bằng nguyên tử kim loại. Hóa trị của gốc axit bằng số nguyên tử hidro đã được thay thế bằng các nguyên tử kim loại.
VD: NaHSO4, NaHS, NaHSO3,…
Đúng 2
Bình luận (0)
C. CHƯƠNG 6: DUNG DỊCH
I. Dung môi – chất tan – dung dịch
Dung môi là chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Chất tan là chất bị hòa tan trong dung môi
Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan
VD: Trong nước đường, đường là chất tan, nước là dung môi của đường, nước đường là dung dịch
II. Dung dịch chưa bão hòa. Dung dịch bão hòa
Ở một nhiệt độ xác định:
- Dung dịch chưa bão hòa là dung dịch có thể hòa thêm chất tan
- Dung dịch bão hòa là dung dịch không thể hòa thêm chất tan
III. Độ tan của một chất trong nước Khái niệm; Công thức tính:
a. Định nghĩa:
Độ tan (kí hiệu S) của một chất trong nước là số gam chất đó hòa tan trong 100g nước để tạo thành dng dịch bão hòa ở một nhiệt độ nhất định.
b.Công thức tính độ tan: S=\(\dfrac{m_{ct}}{m_{dd}}.100\)
IV. NỒNG ĐỘ DUNG DỊCH
1. Nồng độ phần trăm: Khái niệm; Công thức tính:
Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho ta biết số gam chất tan trong 100g dung dịch
CT :
Trong đó: mct là khối lượng chất tan, tính bằng gam
mdd là khối lượng dung dich, tính bằng gam
khối lượng dung dịch = khối lượng chất tan + khối lượng dung môi
2. Nồng độ mol dung dich: Khái niệm; Công thức tính:
Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan trong 1 lit dung dịch
Trong đó: n : số mol chất tan
V: thể tích dung dịch (lít)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Học sinh tiến hành thảo luận dưới sự hướng dẫn của giáo viên. Học sinh trả lời những câu hỏi sau:
- Hãy trình bày tóm tắt những nội dung chính của băng hình
- Hãy nêu các cách thức di chuyển của chim
- Hãy nêu những tập tính kiếm ăn và sinh sản của chim.
- Cách thức di chuyển:
| Bay và lượn | - Kiểu bay đập cánh |
| - Kiểu bay lượn | |
| Những kiểu di chuyển khác | - Leo trèo |
| - Đi và chạy | |
| - Bơi |
- Tập tính kiếm ăn và sinh sản của chim
| Kiếm ăn | - Tập tính kiếm ăn của chim cũng khá đa dạng. Có những loài hoạt động kiếm ăn về ban ngày (đa số các loài chim như cò, sáo, gà, vịt, ngỗng…) nhưng cũng có những loài lại kiếm án về ban đêm (vạc, cú mèo, …) Có thể chia: - Chim ăn tạp - Chim ăn chuyên: chim ăn hạt, ăn xác chết, ăn hạt, ăn quả |
| Sinh sản | Tập tính sinh sản của các loài chim rất khác nhau. Nhưng, nói chung các giai đoạn trong quá trình sinh sản nuôỉ con của các loài chim gồm : giao hoan (có hiện tượng khoe mẽ), giao phối, làm tố, đẻ trứng, ấp trứng và nuôi con. Các giai đoạn này được biểu hiệnkhác nhau tùy theo các bộ chim. |
Đúng 0
Bình luận (0)
Trong các nội dung sau đây, có bao nhiêu nội dung đúng? (1). Nước tự do không bị hút bởi các phân tử tích điện hay dạng liên kết hóa học (2). Trong hai dạng nước tự do và nước liên kết, thực vật dễ sử dụng nước liên kết hơn. (3). Nước tự do giữ được tính chất vật lí, hóa học, sinh học bình thường của nước nên có vai trò rất quan trọng đối vớ cây. (4). Nước tự do không giữ được các đặc tính vậy lí, hóa học, sinh học của nước nhưng có vai trò đảm bảo độ bền vững của hệ thống keo trong chất nguyên...
Đọc tiếp
Trong các nội dung sau đây, có bao nhiêu nội dung đúng?
(1). Nước tự do không bị hút bởi các phân tử tích điện hay dạng liên kết hóa học
(2). Trong hai dạng nước tự do và nước liên kết, thực vật dễ sử dụng nước liên kết hơn.
(3). Nước tự do giữ được tính chất vật lí, hóa học, sinh học bình thường của nước nên có vai trò rất quan trọng đối vớ cây.
(4). Nước tự do không giữ được các đặc tính vậy lí, hóa học, sinh học của nước nhưng có vai trò đảm bảo độ bền vững của hệ thống keo trong chất nguyên sinh.
A. 0.
B. 1.
C. 2.
D. 3
Đáp án C
(1). Nước tự do không bị hút bởi các phân tử tích điện hay dạng liên kết hóa học à đúng
(2). Trong hai dạng nước tự do và nước liên kết, thực vật dễ sử dụng nước liên kết hơn. à sai, thực vật dễ sử dụng nước tự do hơn
(3). Nước tự do giữ được tính chất vật lí, hóa học, sinh học bình thường của nước nên có vai trò rất quan trọng đối vớ cây. à đúng
(4). Nước tự do không giữ được các đặc tính vật lí, hóa học, sinh học của nước nhưng có vai trò đảm bảo độ bền vững của hệ thống keo trong chất nguyên sinh. à sai
Đúng 0
Bình luận (0)
Trong các nội dung sau đây, có bao nhiêu nội dung đúng? I. Nước tự do không bị hút bởi các phân tử tích điện hay dạng liên kết hóa học II. Trong hai dạng nước tự do và nước liên kết, thực vật dễ sử dụng nước liên kết hơn. III. Nước tự do giữ được tính chất vật lí, hóa học, sinh học bình thường của nước nên có vai trò rất quan trọng đối với cây. IV. Nước tự do không giữ được các đặc tính vậy lí, hóa học, sinh học của nước nhưng có vai trò đảm bảo độ bền vững của hệ thống keo trong chất nguyên sin...
Đọc tiếp
Trong các nội dung sau đây, có bao nhiêu nội dung đúng?
I. Nước tự do không bị hút bởi các phân tử tích điện hay dạng liên kết hóa học
II. Trong hai dạng nước tự do và nước liên kết, thực vật dễ sử dụng nước liên kết hơn.
III. Nước tự do giữ được tính chất vật lí, hóa học, sinh học bình thường của nước nên có vai trò rất quan trọng đối với cây.
IV. Nước tự do không giữ được các đặc tính vậy lí, hóa học, sinh học của nước nhưng có vai trò đảm bảo độ bền vững của hệ thống keo trong chất nguyên sinh
A. 1.
B. 0.
C. 3
D. 2.
Đáp án D
I – Đúng. Vì nước tự do là các dạng nước trong thành phần TB, trong các khoang gian bào, trong các mạch dẫn.. không bị hút bởi các phân tử tích điện hay các dạng liên kết hóa học
II – Sai. Vì nước liên kết là dang nước bị các phân tử tích điện hút bởi 1 lực nhất định hoặc trong các liên kết hóa học ở các thành phần của tế bào do đó cây khó sử dụng hơn so với nước liên kết.
III – Đúng. Vì nước tự do đóng vai trò quan trọng với cây: làm dung môi, làm giảm nhiệt độ của cở thể khi thoát hơi nước, tham gia vào môt số quá trình trao đổi chất, đảm bảo độ nhớt của chất nguyên sinh, giúp cho quá trình tra đổi chất diễn ra bình thường.
IV – Sai. Vì nước liên kết mới có vai trò đảm bảo độ bền vững của hệ thống keo trong chất nguyên sinh.
Đúng 0
Bình luận (0)
Chlorine là gì? Các hoá chất nào được làm từ ClorineNhiều người dân trong ngành nuôi thủy hải sản quá quen thuộc với Chlorine. Đây là một chất hóa học có khả năng khử trùng, diệt khuẩn để các vi sinh vật trong nước không cực kì hiệu quả.Trong chủ đề này, hãy cùng Việt Quang đi tìm hiểu chi tiết về Chlorine là chất gì, những vấn đề thường gặp phải khi sử dụng Chlorine là gì, ứng dụng của chlorine trong đời sống, những lưu ý khi sử dụng chlorine để tránh rủi ro.Tìm hiểu Chlorine là gìChlorine một...
Đọc tiếp
Chlorine là gì? Các hoá chất nào được làm từ Clorine
Nhiều người dân trong ngành nuôi thủy hải sản quá quen thuộc với Chlorine. Đây là một chất hóa học có khả năng khử trùng, diệt khuẩn để các vi sinh vật trong nước không cực kì hiệu quả.
Trong chủ đề này, hãy cùng Việt Quang đi tìm hiểu chi tiết về Chlorine là chất gì, những vấn đề thường gặp phải khi sử dụng Chlorine là gì, ứng dụng của chlorine trong đời sống, những lưu ý khi sử dụng chlorine để tránh rủi ro.
Tìm hiểu Chlorine là gìChlorine một chất hóa học có tác dụng oxy hóa và sát khuẩn cực mạnh. Do vậy nó được dùng khá phổ biến trong đời sống với mục đích khử trùng và tẩy trắng. Ở Việt Nam, chlorine được dùng phổ biến trong thủy sản, dệt nhuộm, xử lý nước cấp và nước thải, nước bể bơi.
Sử dụng chlorine trong xử lý nước thải mang lại nhiều lợi ích thiết thực cho người sử dụng, tuy nhiên lưu ý nếu lạm dụng quá nó sẽ gây ra tác hại cho môi trường và con người.
Các dạng hóa chất chlorine phổ biến trên thị trường hiện nay là hypochlorite canxi ( Ca(OCl)2) - dạng chlorine khan và hypochlorite natri (NaOCl) – dạng dung dịch. Các hóa chất Chlorine có thể tan trong nước và phản ứng tạo ra HOCl và HCl, HOCl tiếp tục ion hóa và tạo ra ion OCl.
Xem thêm: https://chatdochai.net/chlorine-chat-hoa-hoc-dung-de-khu-trung-va-diet-khuan/
Là hóa chất xử lý nước dạng viên nén, màu trắng, có công thức C3O3N3Cl3, hàm lượng pH(1% sol) từ 2,7 – 3,3.
Chlorine-Clorin- Ca(OCl)2: Calcium hypochlorite có tác dụng oxy hóa và sát khuẩn rất mạnh, thường được dùng với mục đích xử lý nước thải, tẩy trắng và khử trùng bể bơi, loại bỏ nhiều cặn bẩn, ngăn ngừa sự phát triển của rong, rêu tảo trong nước hồ bơi
Chlorine khử trùng nước bể bơi có xuất xứ tại Trung Quốc, có dạng bột, màu trắng. Có tính oxy hóa mạnh dễ tan trong nước ứng dụng phổ biến trong khử trùng nước bể bơi, nước thải công nghiệp,… Với công thức hóa học Ca(ClO)2, dạng hình thái bột trắng có thể dễ dàng phân biệt, sử dụng.
Công dụng: làm sạch, diệt khuẩn, xử lý nước bể bơi bị đục, xanh, rong rêu, ứng dụng trong công nghệ tẩy trắng, chế biến thực phẩm, chuyên dùng làm nước tẩy rửa, lau sàn tại bệnh viện,.
Dùng trong công nghiệp xử lý nước: Sinh hoạt, nước cấp, nước nuôi trồng thủy sản, nước bể bơi, nước thải
Trong ngành công nghiệp tẩy trắng: bột giấy, dệt, vải sợi
Khử trùng khử mùi, diệt khuẩn: Trong nước bể bơi, vệ sinh dân dụng, nhà hàng, khách sạn, lò mổ, lò chế biến thực phẩm, bệnh viện,..
Để phát huy hiệu quả của sản phẩm tối đa và tránh những rủi ro không đáng có trong quá trình sử dụng thì khách hàng cần tuân thủ một số lưu ý dưới đây:
1. Lưu ý trước khi sử dụng ChlorineTrang bị đầy đủ các vật dụng như quần áo, khẩu trang, kính, găng tay, mũ khi tiếp xúc với hóa chất.
Tranh xúc bột Clo ở nơi có nhiều gió
Khi hóa chất rơi vào người, tay thì phải rửa ngay dưới vòi nước sạch. Nếu không may bị hóa chất vào mắt, miệng cần đến ngay cơ sở y tế gần nhất.
Khi hít có triệu chứng ho, đau ngực, nhức đầu,… nên đến ngay cơ sở y tế để hỏi ý kiến của bác sĩ.
Tiếp xúc với clorin lỏng dẫn đến bỏng nặng thì hãy ngay lập tức rửa dưới nước sạch trong 15 phút nhé.
2. Lưu ý trong quá trình sử dụng ChlorineKhông sử dụng hóa chất dưới ánh nắng trực tiếp sẽ giảm công dụng khử trùng của chlorine
Dùng đúng liều lượng, không nên sử dụng quá liều gây độc hại, ảnh hưởng tới sức khỏe.
Dùng oxy già để trung hòa lại Clo dư khi liều lượng nhiều.
3. Bảo quản sau khi sử dụngCất giữ nơi khô ráo, thoáng mát, không tiếp xúc ánh nắng trực tiếp.
Không cất giữ chung các hóa chất khác và tránh nơi ẩm ướt.
Tuân thủ đúng hướng dẫn sử dụng.
Bảo quản hóa chất xa tầm tay trẻ em
Lời kếtQua bài viết trên với những chia sẻ rất kỹ về Chlorine là gì, ứng dụng trong đời sống, những hoá chất nào được làm từ Chlorine và những vấn đề xoay quanh. Mong rằng bạn sẽ có cái nhìn tổng quát và hiểu hơn về Chlorine để sử dụng hóa chất này một cách hợp lý và tối ưu nhất.
Tham khảo thêm một số thông tin và nguồn tin bổ ích khác về hóa học tại https://chatdochai.net/
Em hãy nêu một số tính chất vật lí và tính chất hóa học của một chất mà em biết?
Sắt:
Tính chất vật lí: tính dẫn điện, tính dẫn nhiệt, tính dẻo, ánh kim.
Tính chất hóa học: tác dụng với oxi trong không khí
Đúng 0
Bình luận (0)