Điện phân dung dịch H 2 S O 4 có kết quả sau cùng là H 2 O bị phân tích thành H 2 và O 2 . Sau 32 phút thể tích khí O 2 thu được là bao nhiêu nếu dòng điện có cường độ 2,5A chạy qua bình và quá trình trên làm ở điều kiện tiêu chuẩn

Những câu hỏi liên quan
Cho dd A chứa CuSO4 nồng độ x%. Sau khi bay hơi 20% khối lượng nước thì dung dịch bão hòa. Thêm 2,75g CuSO4 vào dung dịch bão hòa thì có 5g CuSO4.5H2O kết tinh
a) Tính nồng độ phần trăm dung dịch bão hòa
b) Tính nồng độ phần trăm dung dịch A
Số mol của CuSO4.5H2O=5/160= 0,02 mol.
=> Trong 5 gam tinh thể có 0,02*160=3,2 gam CuSO4 và 1,8 gam H2O.
Lượng CuSO4 tách ra = 3,2 - 2,75 = 0,45 gam.
Lượng H2O tách ra = 1,8 gam.
C% của dung dịch bão hòa= 0,45*100%/(0,45+1,8)= 20%.
Lượng H2O trong dung dịch A ban đầu = 1,8*100/80= 2,25 gam.
Nồng độ dung dịch A= 0,45*100/(0,45+2,25)= 16,67%.
Đúng 0
Bình luận (0)
Hãy tính nồng độ [H+] nồng độ [OH-] và so sánh kết quả thu được với 10M/l trong các trường hợp sau :
a. Hòa tan 4g NaOH vào nước được 10l dung dịch B1
b. Hòa tan 7,4g Ca(OH)2 vào nước được 20 l dung dịch B2
c. Hào tan hỗn hợp X gồm 0,4g NaOH và 0,56g KOH vào nước được dung dịch B3
Đọc tiếp
Hãy tính nồng độ [H+] nồng độ [OH-] và so sánh kết quả thu được với 10M/l trong các trường hợp sau :
a. Hòa tan 4g NaOH vào nước được 10l dung dịch B1
b. Hòa tan 7,4g Ca(OH)2 vào nước được 20 l dung dịch B2
c. Hào tan hỗn hợp X gồm 0,4g NaOH và 0,56g KOH vào nước được dung dịch B3
![]()
1. Nối 2 cực của nguồn điện được đấu trong hộp kín với 2 thanh than A và B. Sau đó nhúng 2 thanh than vào dung dịch muối bạc, sau 1 thời gian thấy có bạc bám vào thanh A.
a)Dòng điện chạy qua thanh A đã nối với cực dương hay cực âm của dòng điện?
b)Hiện tượng trên là kết quả của tác dụng nào của dòng điện?
2.Hãy so sánh chiều của dòng điện trong kim loại.
Giữ nguyên nồng độ dung dịch Na2S2O3 ban đầu, pha loãng dung dịch H2SO4 tương tự như cách pha loãng dung dịch Na2S2O3 theo Bảng 16.1, kết quả thí nghiệm sẽ thay đổi thế nào?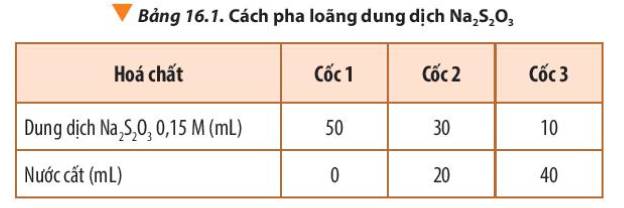
Khi pha loãng dung dịch H2SO4
=> Nồng độ H2SO4 giảm
=> Tốc độ phản ứng giảm
Đúng 1
Bình luận (0)
Câu 4: Cho 31,2 gam BaCl 2 tác dụng vừa đủ với dung dịch H 2 SO 4 19,6%
a) Tính khối lượng kết tủa trắng thu được?
b) Tính khối lượng dung dịch H 2 SO 4 cần dùng?
c) Tính nồng độ phần trăm dung dịch acid thu được sau phản ứng?
( Mg = 24, H =1, O = 16, Cl = 35,5; Ba = 137, S = 32)
\(n_{BaCl_2}=\dfrac{31,2}{208}=0,15mol\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
0,15 0,15 0,15 0,3
a)\(m_{BaSO_4}=0,15\cdot233=34,95\left(g\right)\)
b)\(m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{14,7}{19,6}\cdot100=75\left(g\right)\)
c)\(m_{HCl}=0,3\cdot36,5=10,95\left(g\right)\)
\(m_{ddsau}=31,2+75-34,95=71,25\left(g\right)\)
\(\Rightarrow C\%_{HCl}=\dfrac{10,95}{71,25}\cdot100\%=15,37\%\)
Đúng 2
Bình luận (0)
1) Điện phân 500 ml dung dịch KCl 1M tới khi ở anot thoát ra 4,48 lít khí (đktc) thì ngừng điện phân. Thêm dung dịch AgNO3 dư vào dung dịch còn lại sau điện phân, thu được a gam kết tủa. Tính a.2) Điện phân 500 ml dung dịch CuCl2 tới khi khối lượng dung dịch giảm mất 27 gam thì ngưng điện phân. Thổi khí H2S dư vào phần dung dịch còn lại sau điện phân, thu được 9,6 gam kết tủa. Tính khối lượng catot tăng thêm. Tính nồng độ mol của dung dịch trước khi điện phân. Tính điện lượng tiêu tốn.
Đọc tiếp
1) Điện phân 500 ml dung dịch KCl 1M tới khi ở anot thoát ra 4,48 lít khí (đktc) thì ngừng điện phân. Thêm dung dịch AgNO3 dư vào dung dịch còn lại sau điện phân, thu được a gam kết tủa. Tính a.
2) Điện phân 500 ml dung dịch CuCl2 tới khi khối lượng dung dịch giảm mất 27 gam thì ngưng điện phân. Thổi khí H2S dư vào phần dung dịch còn lại sau điện phân, thu được 9,6 gam kết tủa.
Tính khối lượng catot tăng thêm. Tính nồng độ mol của dung dịch trước khi điện phân. Tính điện lượng tiêu tốn.
1) Điện phân 500 ml dung dịch KCl 1M tới khi ở anot thoát ra 4,48 lít khí (đktc) thì ngừng điện phân. Thêm dung dịch AgNO3 dư vào dung dịch còn lại sau điện phân, thu được a gam kết tủa. Tính a.
2) Điện phân 500 ml dung dịch CuCl2 tới khi khối lượng dung dịch giảm mất 27 gam thì ngưng điện phân. Thổi khí H2S dư vào phần dung dịch còn lại sau điện phân, thu được 9,6 gam kết tủa.
Tính khối lượng catot tăng thêm. Tính nồng độ mol của dung dịch trước khi điện phân. Tính điện lượng tiêu tốn.
Đọc tiếp
1) Điện phân 500 ml dung dịch KCl 1M tới khi ở anot thoát ra 4,48 lít khí (đktc) thì ngừng điện phân. Thêm dung dịch AgNO3 dư vào dung dịch còn lại sau điện phân, thu được a gam kết tủa. Tính a.
2) Điện phân 500 ml dung dịch CuCl2 tới khi khối lượng dung dịch giảm mất 27 gam thì ngưng điện phân. Thổi khí H2S dư vào phần dung dịch còn lại sau điện phân, thu được 9,6 gam kết tủa.
Tính khối lượng catot tăng thêm. Tính nồng độ mol của dung dịch trước khi điện phân. Tính điện lượng tiêu tốn.
Câu 1:
nNaCl = 0,5mol
Khí ở anot là clo.
nCl2=4,48/22,4=0,2mol
PTHH: 2KCl + 2H2O → 2KOH + H2 + Cl2
=> nCl2(pư )= nKOH=0,4mol
=> Dư 0,1 mol KCl.
AgNO3+KCl→AgCl+H2O
2AgNO3+2KOH→Ag2O+2KNO3+H2O
=> m↓=mAgCl+mAg2O=0,1.143,5+0,2.232=60,75g
Câu 2:
Gọi x là mol CuCl2 phản ứng
PTHH: CuCl2 →Cu+Cl2
Khối lượng dd giảm là khối lượng Cu và khí clo.
=> 64x+71x=27
=> x=0,2
Khối lượng catot tăng là khối lượng Cu.
=> Δmcatot=0,2.64=12,8g
=> nCuS↓=9,6/96=0,1mol=nCuCl2dư
=> ΣnCuCl2=0,2+0,1=0,3mol
=> CMCuCl2=0,3/0,5=0,6M
Đúng 0
Bình luận (0)
Lượng SO3 cần thêm vào dung dịch H2SO4 10% để được 100 gam H2SO4 20% ( gam ) gần bằng giá trị nào sau đây:
A. 2,5 B. 8,88 C. 6,67 D. 24,5 E. Kết quả khác
Cho 114g dung dịch H 2 SO 4 20% vào 400g dung dịch BaCl 2 5,2%. Nồng độ % của các chất có trong
dung dịch sau phản ứng là?
A. 1,49% và 2,65% C. 1,6% và 2,65% B. 1,49% và 3% D. Kết quả khác
\(n_{H_2SO_4}=\frac{114.20\%}{98}\approx0,23mol\)
\(n_{BaCl_2}=\frac{400.5,2\%}{208}=0,1mol\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
Xét tỷ lệ: \(n_{BaCl_2}< n_{H_2SO_4}\)
Vậy \(H_2SO_4\) dư
\(\rightarrow n_{H_2SO_4\left(\text{dư}\right)}=0,23-0,1.2=0,03mol\)
Theo phương trình \(n_{BaSO_4}=n_{BaCl_2}=0,1mol\) và \(n_{HCl}=2n_{BaCl_2}=0,2mol\)
\(\rightarrow m_{BaSO_4}=0,1.233=23,3g\) và \(m_{HCl}=0,2.36,5=7,3g\)
\(m_{H_2SO_4\left(\text{dư}\right)}=0,03.98=2,94g\)
\(\rightarrow m_{ddsau}=114+400-23,3=490,7g\)
\(\rightarrow C\%_{H_2SO_4\left(\text{dư}\right)}=\frac{2,94}{490,7}.100\%\approx0,599\%\)
\(C\%_{HCl}=\frac{7,3}{490,7}.100\%\approx1,49\%\)
Vậy chọn A.
Thực hiện các thí nghiệm sau: (a) Nhiệt phân Hg(NO3)2. (b) Điện phân dung dịch AlCl3. (c) Điện phân dung dịch ZnSO4. (d) Cho Al vào dung dịch Fe2(SO4)3 dư. (e) Nung nóng Fe2O3 với CO dư. (g) Cho Ba vào dung dịch NaHCO3. (h) Nhiệt phân KClO3. (i) Cho Na vào dung dịch CuCl2 (dư). Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là: A. 3 B. 5 C. 2 D. 4
Đọc tiếp
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân Hg(NO3)2.
(b) Điện phân dung dịch AlCl3.
(c) Điện phân dung dịch ZnSO4.
(d) Cho Al vào dung dịch Fe2(SO4)3 dư.
(e) Nung nóng Fe2O3 với CO dư.
(g) Cho Ba vào dung dịch NaHCO3.
(h) Nhiệt phân KClO3.
(i) Cho Na vào dung dịch CuCl2 (dư).
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là:
A. 3
B. 5
C. 2
D. 4
Chọn A
(a) Nhiệt phân Hg(NO3)2 thu được Hg (ghi nhớ: nhiệt phân muối nitrat của kim loại từ Ag trở đi thu được kim loại)
(b) Điện phân dung dịch AlCl3: Al3+ không bị điện phân (ghi nhớ: các kim loại đứng sau Al3+ mới bị điện phân)
(c) Điện phân dung dịch ZnSO4 thu được Zn
(d) Cho Al vào dung dịch Fe2(SO4)3 dư thu được Al2(SO4)3 và FeSO4 (dựa theo quy tắc α)
(e) Nung nóng Fe2O3 với CO dư thu được Fe (ghi nhớ: các oxit của kim loại đứng sau Al bị khử bởi CO, H2 thu được kim loại)
(g) Cho Ba vào dung dịch NaHCO3 không thu được kim loại
(h) Nhiệt phân KClO3 không thu được kim loại
(i) Cho Na vào dung dịch CuCl2 (dư) không thu được kim loại
Vậy các phản ứng thu được kim loại là (a) (c) (e)
Đúng 0
Bình luận (0)






















