c ( các thể tích khí đo ở cùng điều kiện nhiệt dọ và áp suất); tỉ khối của Y so với H2 bằng 12. Công thức phân tử của X là :
A. C6H14
B. C3H8
C. C4H10
D. C5H12
Cần bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lit khí amoniac? Biết rằng thể tích của các khí đề được đo ở cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%?
Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
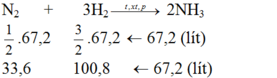
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
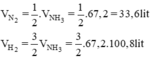
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
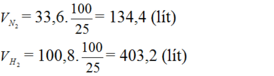
Cracking hoàn toàn một thể tích ankan thu được ba thể tích hỗn hợp Y ( các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất); dy/H2= 12. Xác định CTPT của X
\(n_{ankan}=x\left(mol\right)\)
\(\Rightarrow n_Y=3x\left(mol\right)\)
\(M_Y=12\cdot2=24\left(\dfrac{g}{mol}\right)\)
\(\)\(BTKL:\)
\(m_{ankan}=m_Y\)
\(\Rightarrow x\cdot M=3x\cdot M_Y\)
\(\Rightarrow M=24\cdot3=72\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow14n+2=72\)
\(\Leftrightarrow n=5\)
\(CT:C_5H_{12}\)
Đốt hỗn hợp gồm 5,0 lít khí O2 và 3,0 lít khí NH3 (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Hỗn hợp khí và hơi thu được sau phản ứng là
\(4NH_3+5O_2\xrightarrow[]{t^o}4NO+6H_2O\)
Ban đầu 5 3 (lít)
Phản ứng 4 3 (lít)
Sau phản ứng: 1 0 4 (lít)
Vậy hỗn hợp sau phản ứng gồm NO, $NH_3$ dư
A là hiđrocacbon mạch hở, thể khí ở điều kiện thường. Khi đốt cháy hoàn toàn A bằng khí oxi (vừa đủ) thấy thể tích khí và hơi của các sản phẩm bằng tổng thể tích các khí tham gia phản ứng (thể tích các khí và hơi đều đo ở cùng điều kiện nhiệt độ và áp suất). Xác định công thức phân tử, công thức cấu tạo của A.
Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
1 → (x + 0,25y) x 0,5y
Thể tích và số mol tỉ lệ thuận nên thể tích bằng nhau thì số mol cũng bằng nhau
Theo đề bài: n(khí trước pứ) = n(khí sau pứ)
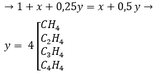
Đốt cháy hoàn toàn 4,48 lít hỗn hợp 2 khí metan và etilen cần dùng 11,2 lít khí oxi.Phần trăm theo thể tích các khí trong hỗn hợp ban đầu lần lượt là(các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất)
đốt cháy hoàn toàn 2 thể tích hợp chất A cần 9 thể thích khí O2 và tạo ra 6 thể tích khí cacbonic và 8 thể tích hơi nước. Các chấy khí và hơi đo ở cùng điều kiện về nhiệt độ, áp suất. Xác định CTPT của A
Giả sử khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
\(n_A=\dfrac{2}{1}=2\left(mol\right)\)
\(n_{O_2}=\dfrac{9}{1}=9\left(mol\right)\)
\(n_{CO_2}=\dfrac{6}{1}=6\left(mol\right)\)
\(n_{H_2O}=\dfrac{8}{1}=8\left(mol\right)\)
Bảo toàn C: nC(A) = 6 (mol)
Bảo toàn H: nH(A) = 16 (mol)
Bảo toàn O: \(n_{O\left(A\right)}=6.2+8.1-9.2=2\left(mol\right)\)
Số nguyên tử C là \(\dfrac{6}{2}=3\) (nguyên tử)
Số nguyên tử H là \(\dfrac{16}{2}=8\) (nguyên tử)
Số nguyên tử O là \(\dfrac{2}{2}=1\) (nguyên tử)
=> CTPT: C3H8O
Đốt cháy hoàn toàn một thể tích khí metan cần dùng 336 ml không khí (a) Tính thể tích khí metan đã cháy (b) Tính thể tích khí CO2 tạo thành. Biết oxi chiếm 1/5 thể tích không khí. Các khí đo ở cùng điều kiện nhiệt độ và áp suất
\(V_{O_2}=\dfrac{336}{5}=67,2\left(ml\right)=0,0672\left(l\right)\\ n_{O_2}=\dfrac{0,0672}{22,4}=0,003\left(mol\right)\\ CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ n_{CO_2}=n_{CH_4}=\dfrac{0,003}{2}=0,0015\left(mol\right)\\ a,V_{CH_4\left(đktc\right)}=0,0015.22,4=0,0336\left(l\right)\\ b,V_{CO_2\left(đktc\right)}=V_{CH_4\left(đktc\right)}=0,0336\left(l\right)\)
Khi đốt 1 lít khí X cần 6 lít O2 thu được 4 lít CO2 và 5 lít hơi H2O (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất). CTPT của X là
A. C4H10O
B. C4H8O2
C. C4H10O2
D. C3H8O
Khi đốt 1 lít khí X cần 6 lít O2, thu được 4 lít CO2 và 5 lít hơi H2O (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất). CTPT của X là
A. C4H10O
B. C4H8O2
C. C3H8O
D. C4H10O2